Содержание
Применение
Цех электролиза меди завода «Уралэлектромедь».Катоды опущены в ванны с электролитом
Аноды
Катоды
Электролиз широко применяется в современной промышленности. В частности, электролиз является одним из способов промышленного получения алюминия, меди, водорода, диоксида марганца, пероксида водорода. Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации).
Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
История
Устройство, изобретенное Иоганном Вильгельмом Риттером для разработки электролиза воды.
Ян Рудольф Дейман и Адриан Паэтс ван Трооствейк использовали в 1789 году электростатическую машину для производства электричества, которое разряжалось на золотых электродах в лейденской банке с водой. В 1800 году Алессандро Вольта изобрел гальваническую батарею , а несколько недель спустя английские ученые Уильям Николсон и Энтони Карлайл использовали ее для электролиза воды. В 1806 году Хамфри Дэви сообщил о результатах обширных экспериментов по электролизу дистиллированной воды, сделав вывод о том, что азотная кислота образуется на аноде из растворенного атмосферного азота. Он использовал высоковольтную батарею и нереактивные электроды и сосуды, такие как конусы золотых электродов, которые дублировались как сосуды, перекрытые влажным асбестом. Когда Зеноб Грамм изобрел машину Грамма в 1869 году, электролиз воды стал дешевым методом производства водорода. Метод промышленного синтеза водорода и кислорода электролизом был разработан Дмитрием Лачиновым в 1888 году.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.
Первый закон Фарадея
Основная статья: Законы электролиза Фарадея
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
m=k⋅q=k⋅I⋅t{\displaystyle m=k\cdot q=k\cdot I\cdot t},если через электролит пропускается в течение времени t постоянный ток с силой тока I.
Коэффициент пропорциональности k{\displaystyle k} называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
- m=miNi{\displaystyle m=m_{i}N_{i}} (1)
- mi=MNa{\displaystyle m_{i}=M/N_{a}} (2)
- Ni=Δqqi{\displaystyle N_{i}={\frac {\Delta q}{q_{i}}}} (3)
- Δq=IΔt{\displaystyle \Delta q=I\Delta t} (4)
- qi=ez{\displaystyle q_{i}=ez}, (5)
- где z — валентность атома (иона) вещества,
- e — заряд электрона
- Подставляя (2)-(5) в (1), получим
- m=μzeNAIΔt{\displaystyle m={\frac {\mu }{zeN_{A}}}I\Delta t}
- m=μzFIΔt{\displaystyle m={\frac {\mu }{zF}}I\Delta t},
где F=eNA{\displaystyle F=eN_{A}} — постоянная Фарадея.
- k=μFz{\displaystyle k={\frac {\mu }{Fz}}}
- m=kIΔt{\displaystyle m=kI\Delta t}
Примеры
Рассмотрим схему электролиза на примере расплавов оксидов, оснований и солей в таблице.
|
Расплав |
Описание |
Пример |
|
Оксид |
– Восстановление металла на катоде: Men+ + ne– = Me; – окисление кислорода на аноде: O-2 – 2e– = O2 |
2K2O = 4K + O2 |
|
Основание |
– Восстановление металла на катоде: Men+ + ne– = Me; – окисление кислорода в составе гидроксидной группы на аноде: 4OH− – 4e = 2H2O + O2 |
|
|
Бескислородная соль |
– Восстановление металла на катоде: Men+ + ne– = Me; – окисление бескислородного аниона на аноде: An- – ne– = A |
2NaBr = 2Na + Br2 или NaBr → Na+ + Br– |
|
Кислородсодержащая соль |
– Восстановление металла на катоде: Men+ + ne– = Me; – окисление кислородного аниона на аноде: 2AO2- – 4e– = 2AO2- + O2 |
Электролиз является промышленным способом получения металлов, нанесения металлического покрытия, воспроизведения формы предметов.
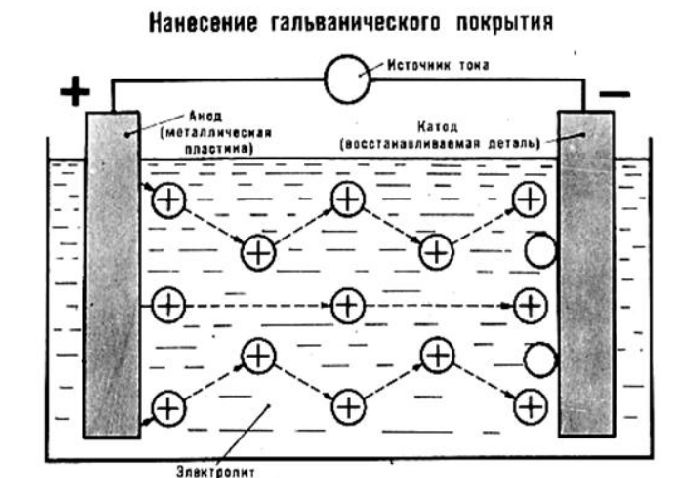
Рис. 3. Схема нанесения гальванического покрытия.
Что мы узнали?
Электролиз – окислительно-восстановительный процесс при участии электрического тока. В расплавах с помощью электричества исходное вещество разделяется на катионы металла и анионы. Положительно заряженные катионы стремятся к катоду – отрицательно заряженному электроду. Анионы – отрицательно заряженные ионы – оседают на положительно заряженном аноде. Поэтому на катоде происходит восстановление, на аноде – окисление. С помощью электролиза расплава получают металлы, наносят металлическое покрытие и воспроизводят форму объектов.
Тест по теме
-
Вопрос 1 из 5
Как протекает электролиз на катоде?
- К катоду движутся отрицательно заряженные катионы, происходит процесс восстановления
- К катоду движутся положительно заряженные катионы, происходит процесс окисления
- К катоду движутся отрицательно заряженные катионы, происходит процесс окисления
- К катоду движутся положительно заряженные катионы, происходит процесс восстановления
Начать тест(новая вкладка)
Электролиз растворов
Использование воды для приготовления раствора электролита осложняет процесс. В растворах солей и щелочей вода ведёт себя при электролизе неоднозначно. Это проявляется в том, что H2O ведёт себя как окислитель, так и как восстановитель. На катоде она получает электроны и восстанавливает атомы водорода до газообразной формы водорода. На аноде вода отдаёт отрицательно заряженные частицы, тогда атомы кислорода окисляются до газообразной формы кислорода. Кислота, используемая в качестве раствора для электролита, лишена этой проблемы.
Катодные процессы
Катод, помещённый в растворы солей, притягивает к себе катионы металлов. Эти катионы выступают как окислители.
Важно! У отдельных металлов способности ионов окислять различны. Чтобы оценить способности окисления – восстановления, необходимо опираться на электрохимический ряд напряжений

Электрохимический ряд металлов
У каждого металла (далее обозначен как М) свой электрохимический потенциал (ЭХП). Чем он меньше, тем восстановительные свойства выше, а окислительная способность у соответствующих ионов этого металла ниже.
ЭХП величина относительная, потому у отдельных ионов разная величина ЭХП. У водорода он равен нулю.
Во время процесса электролиза, протекающего в растворах солей, выявлены следующие замечания:
- когда в солях присутствуют активные М, то не они восстанавливаются на катоде, а водород;
- если М в электролите имеет среднюю активность, то на катоде разряжаются (восстанавливаются) оба: и водород, и М;
- при неактивном М на катоде восстанавливается только он, потому что его ион – более сильный окислитель, чем водородный ион.
Примерами таких процессов на катоде могут служить следующие реакции:
- при активном М: 2H2O +2ē → H2 + 2OH—;
- при М средней активности: Men+ + nē → Me0 и 2H+2O +2ē → H20 + 2OH—, где Ме – это растворённый металл;
- в случае неактивного М в солях: Men+ + nē → Me0.
Замечено, что, когда с катодом взаимодействуют водородные катионы H+, происходит их разряжение до молекул водорода — 2H+ + 2ē → H20
Анодные процессы
Плюс, поданный на анод, притягивает к себе анионы вместе с молекулами воды. В данном случае анод является окислителем, а восстановители – молекулы H2O или анионы кислотных остатков.
В процессе гальванолиза на аноде происходят следующие реакции:
- кислотные остатки, не содержащие кислорода, окисляются до нулевой степени окисления: неМеn- – nē = неМе0, где – неМе – это неметалл;
- при содержании в остатке кислорода окисляется вода и выделяет молекулы кислорода (молекулярный кислород О2): 2H2O-2 – 4ē → O20 + 4H+;
- в случае контакта с анодом гидроксид-иона последний также окисляется: 4O-2H– – 4ē → O20 + 2H2O, с выделением молекулярного кислорода.
Исключение. Фтор обладает электроотрицательностью более высокой, чем кислород. Поэтому электролиз растворов фторидов протекает с окислением молекул воды вместо фторид-ионов.
Суммарные процессы электролиза
Что получается в суммарной реакции гальванолиза, можно рассмотреть на примере хлорида натрия. При пропускании электрического тока на электродах происходит следующее:
- катод – на нём восстанавливается H – водород: 2H+2O +2ē → H20 + 2OH–;
- анод – на электроде происходит окисление хлорид-ионов: 2Cl– – 2ē → Cl20.
В этой реакции электролиза не принимают участия ионы натрия. Тем не менее, они входят в суммарное уравнение раствора хлорида натрия при электролизе. Оно имеет вид:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
Особенности электролиза в растворах
Важно учитывать тот факт, что, помимо ионов электролита, есть также в растворе и продукты диссоциации воды: катионы водорода и анионы гидроксильной группы. Именно поэтому у катода возможна разрядка и катиона электролита, и протона водорода. У анода осуществляется разрядка гидроксильных ионов и анионов электролита
У анода осуществляется разрядка гидроксильных ионов и анионов электролита.

Также молекулы воды вполне могут подвергаться электрохимическому восстановлению или окислению.
При тщательном рассмотрении катодных процессов, которые протекают в ходе электролиза водного раствора, важно учитывать величину потенциала восстановления протонов водорода. Он зависит от концентрации катионов водорода, имеющего значение -0, 41 В. Если в растворе электролита присутствует металл, у которого электродный потенциал имеет более положительное значение, следовательно, у катода в рамках электролиза будет наблюдаться его восстановление
Это утверждение относится к тем металлам, которые в электрохимическом ряду напряжений Бекетова располагаются вблизи водорода. При более отрицательном значении электродного потенциала, чем у катионов водорода, металл не будет восстанавливаться на катоде. В таких случаях на данном электроде скапливается водород
Если в растворе электролита присутствует металл, у которого электродный потенциал имеет более положительное значение, следовательно, у катода в рамках электролиза будет наблюдаться его восстановление. Это утверждение относится к тем металлам, которые в электрохимическом ряду напряжений Бекетова располагаются вблизи водорода. При более отрицательном значении электродного потенциала, чем у катионов водорода, металл не будет восстанавливаться на катоде. В таких случаях на данном электроде скапливается водород.
При значении потенциала металла, сходном с показателем -0,41 В, допустимо одновременное образование на катоде как водорода, так и чистого металла .
На характер катодного процесса в случае электролиза раствора соли (щелочи) влияет расположение металла в ряду электрохимических напряжений металлов Бекетова.
При анализе процессов, протекающих на аноде, необходимо учитывать тот факт, что возможно окисление материала анода. Именно поэтому в электрохимии выделят инертный анод, а также электрод, состоящий их активного анода.
Инертным является тот анод, у которого в рамках протекающего электролиза материал не подвергается окислению. Активным считают анод, способный окисляться в ходе электролиза.
Для инертных анодов выбирают платину, уголь, графит. Именно этот вариант рассматривается в школьном курсе химии.

Факторы, влияющие на процесс электролиза
Процесс электролиза зависит от следующих факторов:
- Состав электролита. Значительное влияние оказывают различные примеси. Они подразделяются на 3 типа – катионы, анионы и органика. Вещества могут быть более или менее отрицательными, чем основной металл, что и мешает процессу. Среди органических примесей выделяются загрязнители (например масла) и ПАВ. Их концентрация имеет предельно допустимые значения.
- Плотность тока. В соответствии с законами Фарадея, масса осаждаемого вещества увеличивается с увеличением силы тока. Однако возникают неблагоприятные обстоятельства – концентрированная поляризация, повышенное напряжение, интенсивный разогрев электролита. С учетом этого существуют оптимальные значения плотности тока для каждого конкретного случая.
- рН электролита. Кислотность среды также выбирается с учетом металлов. Например оптимальное значение кислотности электролита для цинка – 140 г/куб.дм.
- Температура электролита. Она влияет неоднозначно. С увеличением температуры растет скорость электролиза, но повышается и активность примесей. Для каждого процесса есть оптимальная температура. Обычно она находится в пределах 38-45 градусов.
1.15. Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. После этого нейтральные атомы хлора соединяются попарно и образуют молекулы хлора Cl2. Хлор выделяется на аноде в виде пузырьков.
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме
4
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется.
| Рисунок 1.15.1.Электролиз водного раствора хлорида меди |
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
Здесь m и q – масса и заряд одного иона, – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m иона данного вещества к его заряду q.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q = ne), то выражение для электрохимического эквивалента k можно записать в виде
Здесь NA – постоянная Авогадро, M = mNA – молярная масса вещества, F = eNA – постоянная Фарадея.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:
Явление электролиза широко применяется в современном промышленном производстве.
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.
Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Будет интересно Что такое электрическое поле: объяснение простыми словам
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
https://youtube.com/watch?v=SwNJwbU_lYU
Выбор электролита
Хоффман вольтаметр подключен к постоянному току источника питания
Если описанные выше процессы происходят в чистой воде, катионы H + будут потребляться / восстанавливаться на катоде, а анионы OH — потребляться / окисляться на аноде. Это можно проверить, добавив к воде индикатор pH : вода возле катода является щелочной, а вода около анода — кислой. Отрицательные ионы гидроксида, которые приближаются к аноду, в основном объединяются с положительными ионами гидроксония (H 3 O + ) с образованием воды. Положительные ионы гидроксония, которые приближаются к катоду, в основном объединяются с отрицательными ионами гидроксида с образованием воды. Относительно небольшое количество ионов гидроксония / гидроксида достигает катода / анода. Это может вызвать перенапряжение на обоих электродах.
Чистая вода является довольно хорошим изолятором, поскольку она имеет низкую автоионизацию , K w = 1,0 × 10 -14 при комнатной температуре, и, таким образом, чистая вода плохо проводит ток, 0,055 мкСм · см -1 . Если не применяется очень большой потенциал, вызывающий увеличение автоионизации воды, электролиз чистой воды протекает очень медленно, ограничиваясь общей проводимостью.
Если добавить водорастворимый электролит, проводимость воды значительно возрастет. Электролит распадается на катионы и анионы; анионы устремляются к аноду и нейтрализуют накопление там положительно заряженного H + ; аналогичным образом , катионы устремляются к катоду и нейтрализовать накопление отрицательно заряженных ОН — там. Это обеспечивает непрерывный поток электричества.
Электролит для электролиза воды
При выборе электролита необходимо проявлять осторожность, поскольку анион электролита конкурирует с ионами гидроксида, отдавая электрон. Анион электролита с меньшим стандартным электродным потенциалом, чем гидроксид, будет окисляться вместо гидроксида, и газообразный кислород не будет образовываться
Катион с большим стандартным электродным потенциалом , чем ион водорода будет уменьшен вместо этого, и ни один газообразного водорода не будет производиться.
Следующие катионы имеют более низкий электродный потенциал, чем H +, и поэтому подходят для использования в качестве катионов электролита: Li + , Rb + , K + , Cs + , Ba 2+ , Sr 2+ , Ca 2+ , Na + и Mg 2. + . Часто используются натрий и литий , так как они образуют недорогие растворимые соли.
Если в качестве электролита используется кислота , катионом является H + , и нет конкурента для H +, образованного путем отделения воды. Наиболее часто используемый анион — сульфат ( SO2- 4), так как он очень трудно окисляется, при этом стандартный потенциал окисления этого иона до пероксидисульфат- иона составляет +2,010 вольт.
Сильные кислоты, такие как серная кислота (H 2 SO 4 ), и сильные основания, такие как гидроксид калия (KOH) и гидроксид натрия (NaOH), часто используются в качестве электролитов из-за их сильной проводящей способности.
Также можно использовать твердый полимерный электролит, такой как нафион, и при нанесении специального катализатора на каждую сторону мембраны может эффективно расщеплять молекулу воды всего лишь с 1,5 вольт. Несколько других систем с твердыми электролитами были испытаны и разработаны с несколькими системами электролиза, которые в настоящее время коммерчески доступны, в которых используются твердые электролиты.
Электролиз чистой воды
Безэлектролитный электролиз чистой воды достигается за счет использования электрохимических ячеек с наноразмерными зазорами с глубиной суб-Дебая . Когда зазор между катодом и анодом даже меньше, чем длина Дебая (1 микрон в чистой воде, около 220 нм в дистиллированной воде), области двойного слоя от двух электродов могут перекрываться, что приводит к равномерно сильному электрическому полю, распределенному внутри всего зазора. . Такое сильное электрическое поле может значительно улучшить перенос ионов внутри воды (в основном из-за миграции), дополнительно усиливая самоионизацию воды и поддерживая протекание всей реакции, а также демонстрируя небольшое сопротивление между двумя электродами. В этом случае две полуреакции связаны вместе и ограничиваются этапами переноса электрона (ток электролиза насыщается при дальнейшем уменьшении расстояния между электродами).
Использование процесса
Электролиз растворов используется в разных отраслях современной промышленности. В химической отрасли с помощью данного процесса получают хлор, щелочи, перхлораты, хлораты, персульфаты, органические вещества, перманганат калия, надсерную кислоту, фтор, кислород, водород, иные ценные продукты.
В цветной металлургии электролиз расплавов применяют для извлечения чистого металла из руд. Металлы, которые нельзя выделять из-за высокого отрицательного потенциала из водных растворов, в цветной металлургии получают электролизом расплавов. Среди металлов, которые получают путем электролиза так называемых расплавленных сред, отметим магний, алюминий, уран, бериллий, цирконий.
Электролиз используют в машиностроении, электронной промышленности, радиотехнике, полиграфии, чтобы наносить тонкие металлические покрытия на изделия, защищая их от коррозии, увеличивая износостойкость, повышая жаропрочность.

Теоретическая часть
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Будет интересно Все о законе Ома: простыми словами с примерами для «чайников»
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
https://youtube.com/watch?v=1PsvHa2gKxU
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к
элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока
Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Электролиз расплавов оснований.
Как работает электролиз.