Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.
Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Будет интересно Что такое электрическое поле: объяснение простыми словам
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
https://youtube.com/watch?v=SwNJwbU_lYU
В чём заключается процесс
Катод — определение и практическое применение
Технологический порядок электролиза, или ещё его называют гальванолизом, происходит по законам химии и физики. При этом берутся электропроводящие растворы (жидкости), в которых при помощи двух электродов организовано электрическое поле.
Внимание! Электроды имеют названия. Катод (К) – электрод, имеющий отрицательный потенциал, анод (А) – электрод с положительным потенциалом
Ионы движутся упорядоченно через раствор, который носит название электролита. При этом ионы, относящиеся к металлам, водороду (катионы) направляются к катоду, к аноду стремятся ионы, принадлежащие к кислотным остаткам или гидроксильной группы (анионы). Катионы имеют положительный знак заряда, анионы – отрицательный. Пропускание электрического тока при электролизе может осуществляться, как через растворы, так и через расплавы электролитов.
Информация. При приготовлении электролита происходит диссоциация раствора на ионы. Это обусловлено взаимодействием растворителя на растворяемое вещество. Такая реакция называется первичной. Дальнейшее воздействие электрического тока на электролит вызывает вторичную реакцию гальванолиза.
Подобное разделение на первичность и вторичность позволило Майклу Фарадею обосновать законы, применяемые к гальванолизу.
Процесс электролиза
История
Слово «электролиз» было введено Майклом Фарадеем в 19 веке по предложению преподобного Уильяма Уэвелла с использованием греческих слов ἤλεκτρον «янтарь», который с 17 века ассоциировался с электрическими явлениями , и λύσις означает «растворение». Тем не менее, электролиз как инструмент для изучения химических реакций и получения чистых элементов предшествует введению термина и формальному описанию Фарадеем.
В начале девятнадцатого века Уильям Николсон и Энтони Карлайл пытались продолжить эксперименты Вольты . Они прикрепили два провода по обе стороны от батареи Вольта, а другие концы поместили в трубку, наполненную водой. Они заметили, когда провода были соединены вместе, что каждая из них образовывала пузыри. Один тип — водород, другой — кислород.
В 1785 году голландский ученый по имени Мартинус Ван Марум создал электростатический генератор, который он использовал для восстановления олова, цинка и сурьмы из их солей с помощью процесса, позже известного как электролиз. Хотя он неосознанно производил электролиз, только в 1800 году Уильям Николсон и Энтони Карлайл обнаружили, как работает электролиз.
В 1791 году Луиджи Гальвани экспериментировал с лягушачьими лапками. Он утверждал, что размещение мышц животного между двумя разными металлическими листами привело к появлению электричества. В ответ на эти утверждения Алессандро Вольта провел собственные тесты. Это могло бы пролить свет на идеи Хэмфри Дэви по электролизу. Во время предварительных экспериментов Хамфри Дэви предположил, что когда два элемента соединяются вместе, образуя соединение, высвобождается электрическая энергия. Хамфри Дэви продолжил создавать таблицы разложения на основе своих предварительных экспериментов по электролизу. Таблицы разложения дадут представление об энергиях, необходимых для разложения определенных соединений.
В 1817 году Йохан Август Арфведсон определил, что в некоторых из его образцов есть еще один элемент, литий; однако он не мог изолировать компонент. Только в 1821 году Уильям Томас Бранде использовал электролиз, чтобы выделить его. Два года спустя он оптимизировал процесс, используя хлорид лития и хлорид калия с электролизом для получения лития и гидроксида лития.
В более поздние годы исследований Хэмфри Дэви его помощником стал Майкл Фарадей. Изучая процесс электролиза под руководством Хамфри Дэви, Майкл Фарадей открыл два закона электролиза .
Во времена Максвелла и Фарадея возникли опасения по поводу электроположительной и электроотрицательной активности.
В ноябре 1875 года Поль Эмиль Лекок де Буабодран открыл галлий, используя электролиз гидроксида галлия, с получением 3,4 мг галлия. В декабре он представил свое открытие галлия Академии наук в Париже.
26 июня 1886 года Фердинанд Фредерик Анри Муассан наконец почувствовал себя комфортно, проводя электролиз на безводном фтористом водороде для создания газообразного элемента с чистым фтором. Прежде чем использовать фтористый водород, Анри Муассан использовал фторидные соли при электролизе. Таким образом, 28 июня 1886 года он провел свой эксперимент перед Академией наук, чтобы продемонстрировать свое открытие нового элемента фтора. Ценой попыток найти элементарный фтор путем электролиза фторидных солей погибли многие химики, в том числе Полен Луайе и Жером Никлес.
В 1886 году Чарльз Мартин Холл из Америки и Поль Эру из Франции подали заявки на американские патенты, Эру — в мае, а Холл — в июле. Холл смог получить свой патент, доказав в письмах своему брату и семье свидетельства того, что его метод был открыт до того, как был подан французский патент. Это стало известно как процесс Холла-Эру, который принес пользу многим отраслям промышленности, потому что цена на алюминий упала с четырех долларов до тридцати центов за фунт.
График
- 1785 г. — электростатический генератор Мартинуса ван Марума был использован для восстановления олова , цинка и сурьмы из их солей с помощью электролиза.
- 1800 — Уильям Николсон и Энтони Карлайл (а также Иоганн Риттер ) разложили воду на водород и кислород .
- 1808 — Калий (1807), натрий (1807), барий , кальций и магний были открыты с помощью электролиза.
- 1821 — Литий был открыт английским химиком Уильямом Томасом Бранде , который получил его электролизом оксида лития.
- 1834 г. — Майкл Фарадей опубликовал свои два закона электролиза , дал им математическое объяснение и ввел такие термины, как электрод, электролит, анод, катод, анион и катион.
- 1875 — Поль Эмиль Лекок де Буабодран открыл галлий с помощью электролиза.
- 1886 — Анри Муассан открыл фтор с помощью электролиза.
- 1886 — Разработан процесс Холла-Эру для производства алюминия.
- 1890 — Разработан процесс Кастнера – Келлнера для производства гидроксида натрия .
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
- анод:
2H2O → O2 + 4H+ + 4e–; - катод:
4H+ + 4e– → 2H2.
Или:
- анод:
3H2O → O3 + 6e– + 6H+; -
катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.
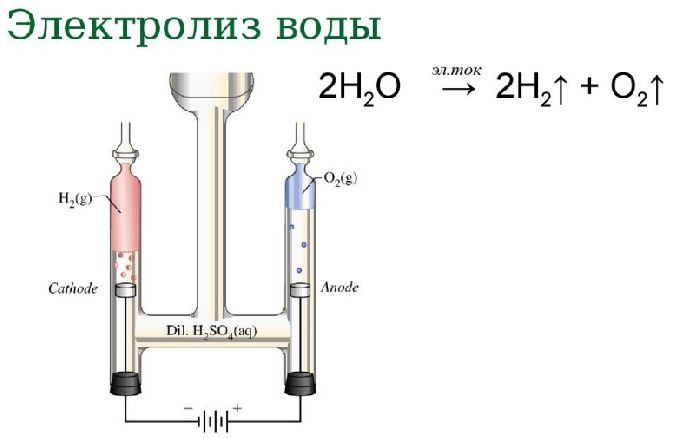
Рис. 2. Схема электролиза воды.
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H+). В противном случае водород не будет произведён. Чтобы исключить конкуренцию, необходимо подобрать электролит, катионы которого будут иметь меньший электродный потенциал, чем H+ воды. На роль катиона электролита подходят:
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
- Mg2+.
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH– воды. В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
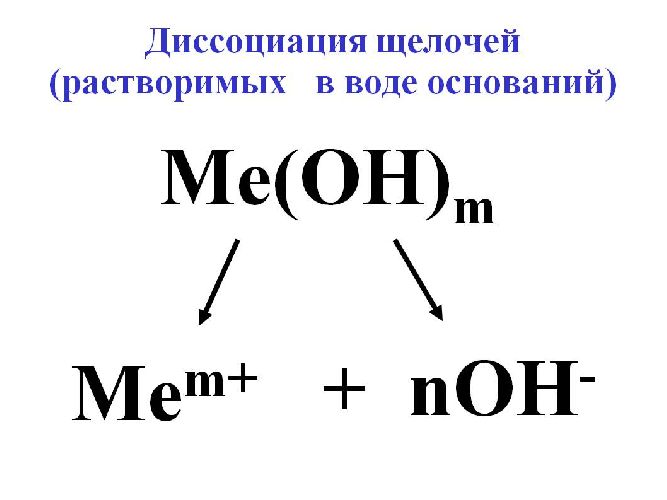
Рис. 3. Диссоциация щёлочи.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
-
Вопрос 1 из 5
К какому электроду движутся катионы?
- К аноду – положительно заряженному электроду
- К аноду – отрицательно заряженному электроду
- К катоду – положительно заряженному электроду
- К катоду – отрицательно заряженному электроду
Начать тест(новая вкладка)
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
Аффинаж серебра в домашних условиях — методы очистки от примесей, подробная инструкция с видео
Для очистки серебра от примесей применяется процедура под названием аффинаж.
Такая технология позволяет при помощи физических действий и использования свойств химических реакций добиться высокой чистоты металла.
Кроме того, аффинаж позволяет добыть серебро из различных устройств радиодеталей.
Процесс проведения реакции для получения конечного результата занимает различное время, которое зависит от выбранного способа аффинажа и загрязнения перерабатываемого сплава.
В статье мы расскажем о различных способах очистки технического серебра от примесей, а также представим вашему вниманию видео на эту тему.
Для выполнения работ потребуются:
- химические реактивы;
- необходимые навыки;
- оборудованное место работы.
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Watch this video on YouTube
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Что такое анод и катод?
Какие существуют виды источников электрического тока?
В чём отличие проводников от диэлектриков, их свойства и сфера применения
Что такое генератор водорода и как его сделать своими руками
Что такое ЭДС индукции и когда возникает?
История открытия электричества
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.
Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии
При этом способе важно, чтобы заготовка отделилась от покрытия

Украшения после гальванопластики
Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.

Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:

k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.