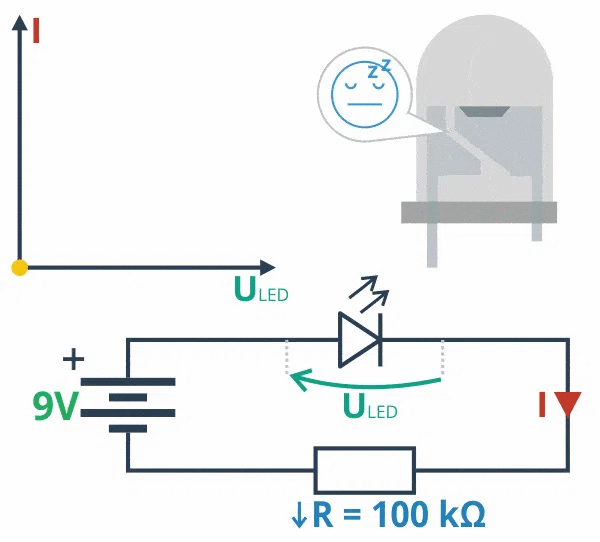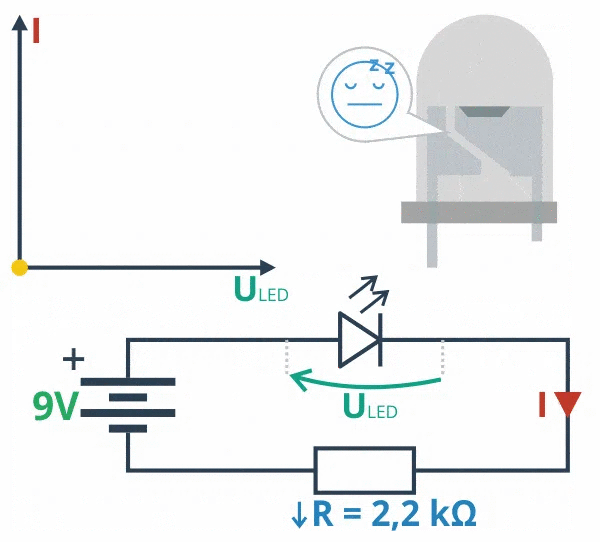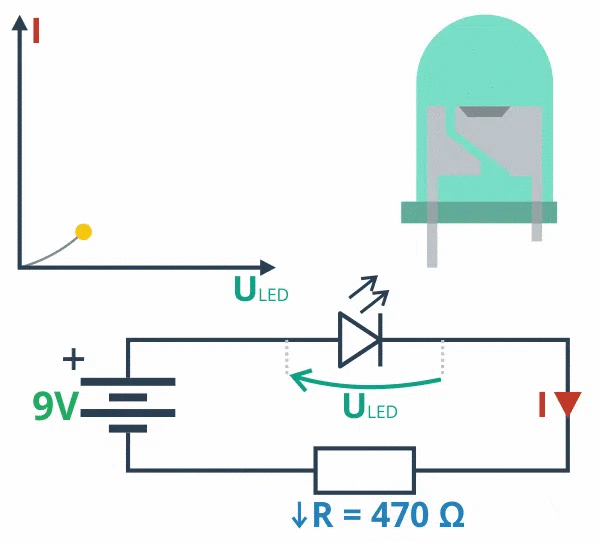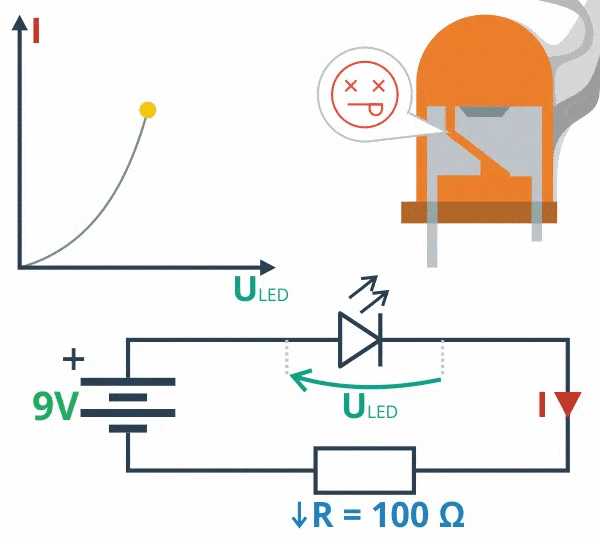
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q
, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
- нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
- если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
- при этом будет верным следующее равенство: Г= Г1+Г2.
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии
При этом способе важно, чтобы заготовка отделилась от покрытия
Украшения после гальванопластики
Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.
Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.
Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.
Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Будет интересно Что такое электрическое поле: объяснение простыми словам
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
https://youtube.com/watch?v=SwNJwbU_lYU
Получение водорода электролизом воды
Получение чистого водорода путем электролиза воды — самая очевидная и эффективная технология, и один из наиболее перспективных способов получения альтернативного топлива. Водород добывают из любого водного раствора, а при сгорании он превращается обратно в воду.
По сравнению с прочими методами получения водорода, электролиз воды отличается целым рядом преимуществ. Во-первых, в ход идет доступное сырье — деминерализованная вода и электроэнергия. Во-вторых, во время производства отсутствуют загрязняющие выбросы. В-третьих, процесс целиком автоматизирован. Наконец, на выходе получается достаточно чистый (99,99%) продукт. Из всех методов электролиза наиболее перспективным считают высокотемпературный электролиз (себестоимость водорода от 2,35 до 4,8 $/кг). Его следует иметь на технологическом вооружении, поскольку при определенных экономических условиях он может быть использован в крупнопромышленном масштабе.
Электролизом воды называется физико-химический процесс, при котором под действием постоянного электрического тока дистиллированная вода разлагается на кислород и водород. В результате разделения на части молекул воды, водорода по объему получается вдвое больше, чем кислорода. Эффективность электролиза такова, что из 500 мл воды получается около кубометра обоих газов с затратами около 4 квт/ч электрической энергии.
Технологический ток для протекания процесса электролиза воды для получения водорода и кислорода получается, как правило, при помощи промышленного выпрямителя с необходимыми рабочими параметрами, Обычно это напряжение до 90В и силой тока до 1500 А. Подходящим агрегатом является Пульсар СМАРТ.
На электронном дисплее выпрямителя Пульсар СМАРТ или в специальном ПО для компьютера можно контролировать все стадии процесса производства, что позволяет оператору следить за параметрами, и круглосуточно журналировать протекание технологического процесса. Полностью автоматическая работа, включающая непрерывный мониторинг всех параметров для безаварийного функционирования без надзора оператора. Все параметры, касающиеся напряжения и силы тока постоянно измеряются и контролируются микропроцессором выпрямителя. Более того, все контролируемые параметры фиксируются устройством, которое в случае сбоя или отклонения может автоматически остановить процесс и сигнализирует об этом при помощи световой колонны.
Выпрямители тока серии Пульсар СМАРТ разработаны в соответствии с самыми высокими требованиями промышленной эффективности и международными стандартами. При этом технологическое программное обеспечение допускает гибкую адаптацию к требованиям Заказчика, и постоянно совершенствуется.
Направления исследований
Электролиз углекислого газа
Электрохимическое восстановление или электрокаталитическое преобразование CO 2 может давать химические вещества с добавленной стоимостью, такие как метан , этилен , этанол и т. Д. Электролиз диоксида углерода дает формиат или монооксид углерода, но иногда и более сложные органические соединения, такие как этилен . Эта технология изучается как углеродно-нейтральный путь к органическим соединениям.
Электролиз подкисленной воды
Электролиз воды производит водород и кислород в соотношении 2: 1 соответственно.
- 2 H 2 O (л) → 2 H 2 (г) + O 2 (г); E = +1,229 В
Энергетическая эффективность электролиза воды колеблется в широких пределах. Эффективность электролизера — это мера энтальпии, содержащейся в водороде (для сгорания с кислородом или какой-либо другой более поздней реакции), по сравнению с подводимой электрической энергией. Значения теплоты / энтальпии для водорода хорошо опубликованы в научных и технических текстах и составляют 144 МДж / кг
Обратите внимание, что топливные элементы (не электролизеры) не могут использовать это полное количество тепла / энтальпии, что привело к некоторой путанице при вычислении значений эффективности для обоих типов технологий. В реакции часть энергии теряется в виде тепла
В некоторых отчетах указывается эффективность от 50% до 70% для щелочных электролизеров; однако гораздо более высокая практическая эффективность доступна при использовании электролиза с полимерным электролитом с мембраной и каталитической технологии, например 95% эффективности.
Национальная лаборатория возобновляемой энергии по оценкам , что 1 кг водорода (примерно эквивалентно 3 кг, или 4 л, нефти с точки зрения энергии) может быть получен путем Ветряные электролиза между $ 5,55 в ближайшем будущем и $ 2,27 в долгосрочной перспективе.
Около 4% газообразного водорода, производимого во всем мире, вырабатывается путем электролиза и обычно используется на месте. Водород используется для производства аммиака для удобрений с помощью процесса Габера и преобразования тяжелых нефтяных источников в более легкие фракции посредством гидрокрекинга . В последнее время для улавливания водорода в водородных топливных элементах в водородных транспортных средствах используется электролиз на месте .
Электролиз воды с использованием углерода / углеводородов
В последнее время для снижения энергозатрат использование углерода ( уголь ), спиртов (углеводородный раствор) и органических растворов ( глицерин , муравьиная кислота, этиленгликоль и т. Д.) При совместном электролизе воды было предложено в качестве жизнеспособного варианта. . Процесс электролиза воды с использованием углерода / углеводородов (так называемый CAWE) для производства водорода будет выполнять эту операцию в одном электрохимическом реакторе. Этот энергетический баланс системы может потребоваться только около 40% потребляемой электроэнергии, при этом 60% приходится на химическую энергию углерода или углеводорода. В этом процессе в качестве топлива используются твердые частицы угля / углерода или порошок в качестве топлива, диспергированного в кислотном / щелочном электролите в виде суспензии, а углеродсодержащий источник участвует в процессе электролиза в соответствии со следующими теоретическими общими реакциями:
Углеродно-угольная суспензия (C + 2H 2 O) -> CO 2 + 2H 2 E ‘= 0,21 В (обратимое напряжение) / E’ = 0,46 В (термо-нейтральное напряжение)
или
Углеродно-угольная суспензия (C + H 2 O) -> CO + H 2 E ‘= 0,52 В (обратимое напряжение) / E’ = 0,91 В (термо-нейтральное напряжение)
Таким образом, этот подход CAWE заключается в том, что фактическое перенапряжение ячейки может быть значительно снижено до уровня ниже 1 В по сравнению с 1,5 В для обычного электролиза воды.
Электрокристаллизация
Специализированное применение электролиза включает рост проводящих кристаллов на одном из электродов из окисленных или восстановленных частиц, которые образуются на месте. Метод был использован для получения монокристаллов низкоразмерных электрических проводников, таких как соли с переносом заряда и соединения с линейной цепью.
Конкурирующие полуреакции при электролизе раствора
При использовании ячейки, содержащей инертные платиновые электроды, электролиз водных растворов некоторых солей приводит к восстановлению катионов (например, осаждению металлов, например, солями цинка) и окислению анионов (например, выделению брома с бромидами). Однако с солями некоторых металлов (например, натрия) водород выделяется на катоде, а для солей, содержащих некоторые анионы (например, сульфат SO 4 2- ), кислород выделяется на аноде. В обоих случаях это происходит из-за того, что вода восстанавливается с образованием водорода или окисляется с образованием кислорода. В принципе, напряжение, необходимое для электролиза раствора соли, может быть получено из стандартного потенциала электрода для реакций на аноде и катоде. Стандартный потенциал электрода напрямую связан со свободной энергией Гиббса , ΔG, для реакций на каждом электроде и относится к электроду без протекания тока. Ниже представлена выдержка из таблицы стандартных электродных потенциалов .
| Половина реакции | E ° (В) | Ref. |
|---|---|---|
| Na + + е — ⇌ Na ( ы ) | −2,71 | |
| Zn 2+ + 2 е — ⇌ Zn ( ы ) | -0,7618 | |
| 2H + + 2 e — ⇌ H 2 ( г ) | ≡ 0 | |
| Br 2 ( водн. ) + 2 e — ⇌ 2Br — | +1.0873 | |
| O 2 ( г ) + 4H + + 4 e — ⇌ 2H 2 O | +1,23 | |
| Cl 2 ( г ) + 2 e — ⇌ 2Cl — | +1,36 | |
| S2О2- 8+ 2 e — ⇌ 2 SO2- 4 | +2,07 |
С точки зрения электролиза эту таблицу следует интерпретировать следующим образом:
- При перемещении вниз по таблице E ° становится более положительным, а количество видов слева будет уменьшаться с большей вероятностью : например, ионы цинка с большей вероятностью будут восстановлены до металлического цинка, чем ионы натрия будут восстановлены до металлического натрия.
- При перемещении вверх по таблице E ° становится более отрицательным, и частицы справа с большей вероятностью будут окисляться : например, металлический натрий с большей вероятностью окисляется до ионов натрия, чем металлический цинк, который окисляется до ионов цинка.
Используя уравнение Нернста потенциал электрода можно рассчитать по концентрации ионов определенной температуры, и число электронов , участвующих. Для чистой воды ( pH 7):
- потенциал электрода для восстановления с образованием водорода составляет -0,41 В
- потенциал электрода для окисления с образованием кислорода +0,82 В.
Сопоставимые цифры, рассчитанные аналогичным образом для 1M бромида цинка , ZnBr 2 , составляют -0,76 В для восстановления до металлического Zn и +1,10 В для окисления с образованием брома. Вывод из этих фигур состоит в том, что водород должен образовываться на катоде, а кислород на аноде в результате электролиза воды, что противоречит экспериментальным наблюдениям, согласно которым металлический цинк осаждается и образуется бром. Объяснение состоит в том, что эти рассчитанные потенциалы указывают только на термодинамически предпочтительную реакцию
На практике необходимо принимать во внимание многие другие факторы, такие как кинетика некоторых стадий реакции. Эти факторы вместе означают, что для восстановления и окисления воды требуется более высокий потенциал, чем прогнозировалось, и это называется перенапряжениями. Экспериментально известно, что перенапряжения зависят от конструкции ячейки и природы электродов.
Экспериментально известно, что перенапряжения зависят от конструкции ячейки и природы электродов.
Для электролиза нейтрального (pH 7) раствора хлорида натрия восстановление иона натрия термодинамически очень затруднено, и вода восстанавливается с выделением водорода, оставляя ионы гидроксида в растворе. На аноде наблюдается скорее окисление хлора, чем окисление воды, поскольку перенапряжение для окисления хлорида до хлора ниже, чем перенапряжение для окисления воды до кислорода . В гидроксид — ионы и растворенного газа хлора реагируют далее с образованием хлорноватистой кислоты . Водные растворы, полученные в результате этого процесса, называются электролизованной водой и используются как дезинфицирующее и чистящее средство.
ХИМИЯ — Комплексная подготовка к внешнему независимому оцениванию
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
6. Смеси веществ. Растворы
6.13. Электролиз
6.13.2. Электролиз водных растворов электролитов (кислот, оснований, солей)
Во время электролиза водных растворов электролитов, кроме катионов и анионов растворенного вещества, в процессах окисления и восстановления, происходящих на электродах, могут участвовать молекулы воды. При этом могут происходить следующие процессы:
• на катоде:(восстанавливается Водород с образованием водорода);
• на аноде:(окисляется Кислород с образованием кислорода).
Или образуются продукты окисления — восстановления воды, зависит от природы растворенного вещества и соответственно химического состава раствора (катионов, анионов)1.
И. Катодные (восстановительные) процессы
На катоде может происходить восстановление катионов металлического элемента, ионов Водорода (в случае электролиза растворов кислот или молекул воды). Ионы металлических элементов восстанавливаются тем легче, чем меньше их электрохимический потенциал:
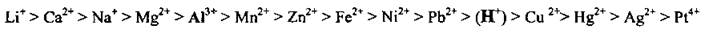
В зависимости от активности металлического элемента, от которого происходит катион, можно выделить три случая электролитических процессов, происходящих на катоде:
|
Li+,Са2+,Na+, Mg2+, Al3+ |
Мn2+,Zn2+, Fe2+, Ni2+, Pb2+ |
Н+ |
Cu2+, Hg2+, Ag+, Pt4+ |
|
Эти катионы, образованные активными металлами, на катоде не восстанавливаются. Восстанавливается вода с образованием водорода: |
Эти катионы восстанавливаются одновременно с молекулами воды, образуя соответствующие металлы и водород: |
Эти катионы восстанавливаются легко и практически полностью с образованием соответствующих металлов: |
II. Анодные (окислительные) процессы
Окислительная способность анионов зависит от их состава. По способности окисляться их также можно разместить в ряд:
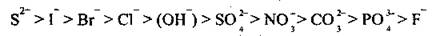
На аноде может происходить окисление анионов только безоксигеновых кислот (за исключением флуорид-ионаF-):
|
S2-, I-, r-, Сl- |
ВОН- |
SO42-, NO3-,СO32-, PO43-,F- |
|
Анионы безоксигеновых кислот (за исключениемF-)легко окисляются: |
Анионы оксигеносодержащих кислот не окисляются, вместо них окисляется вода (выделяется кислород): |
Рассмотрим примеры электролиза водных растворов солей.
Пример 4. Электролиз раствораCuSO4
1. Записываем уравнения электролитической диссоциации купрум(ІІ) сульфата:
2. Возле катода, кроме молекул воды, накапливаются ионы Сu2+, которые и восстанавливаются:
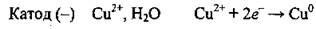
3. Возле анода, кроме молекул воды, накапливаются сульфат-ионыSO42-, которые, однако, не окисляются. Окисляются молекулы воды:
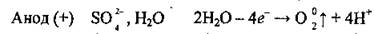
Таким образом образуется сульфатная кислота.
Далее аналогично действиям 4-5 примера 1 проводят электронный баланс, грустят электронные рівняйю и получают молекулярное уравнение электролиза:
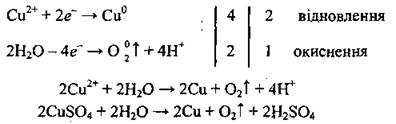
Пример 5. Электролиз водного раствора КСl

Пример 6. Электролиз водного раствораNa2SO4
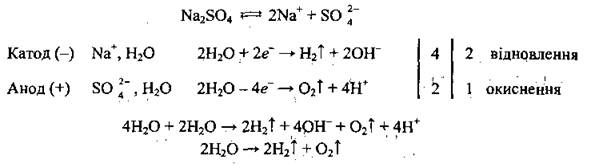
Пример 7. Электролиз водного раствора натрий сульфида
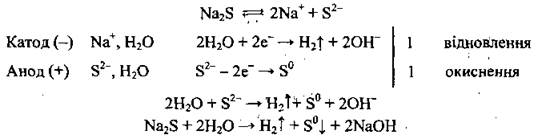
Отметим, что в рассмотренных выше примерах описано электролиз с использованием инертных электродов, их изготавливают из графита, платины, золота, которые не участвуют в электролизе. Электроды, изготовленные из более активных металлов, называют растворимыми, потому что они во время электролиза окисляются.
Пример 8. Электролиз раствораCuSO4с использованием медного анода.
Процессы, которые происходят, подобные тем, что описаны в примере 4:
Но если используют не инертный (графитовый) анод, а растворимый (в нашем случае — медный), происходит его растворения — окисления меди:
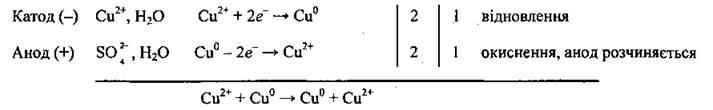
Количество меди, которая восстанавливается на катоде и окисляется при растворении анода, одинакова. Поэтому концентрация ионов Сu2+в растворе остается неизменной. На катоде выделяется чистая медь, а примеси, которые есть в металле анода, остаются в растворе или (чаще) выпадают в осадок (шлам). Такой процесс называют электролитическим рафинированием и используют для очистки меди, никеля, серебра, свинца и других металлов от примесей.
1В общем на ход электролиза и выход конечных продуктов также влияет природа растворителя, концентрация электролита, материал, из которого изготовлены электроды (см. Пример 8), электродный потенциал, температура, некоторые другие условия.
| Назад | Вперед |
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4