Содержание
Понятие об электролизе. Принципиальная схема электролизера.
Гальваника — это осаждение металла или оксида на поверхности изделия для придания ему новых функциональных свойств или улучшения внешнего вида. Гальваника выполняется под действием электрического тока, отсюда возникает понятие «электролиз».
Электролиз с практической точки зрения является комплексом окислительно-восстановительных реакций, протекающих под действием электрического тока в электролите.
Электролит — это среда (для классической гальваники — водный раствор), обладающая ионной электрической проводимостью. Проще говоря — жидкость, способная проводить через себя электрический ток. Электрический ток проводится в основном за счет сольватированных в растворителе ионов. Сольватация является своего рода «растаскиванием» ионов из прочной кристаллической решетки твердого вещества диполями воды. В результате каждый ион становится окружен некоторым количеством молекул воды и в этом виде передвигается либо к положительному, либо к отрицательному электроду.
Когда через электролит пропускается электрический ток, то первоначально происходит направленное движение электронов в металлических проводниках. От анода электроны переходят к катоду, в результате чего на аноде образуется избыточный положительный заряд. При включенной электрической цепи с внешним источником тока на растворимом аноде будет происходить отнятие электронов у атомов металла-основы анода, а на нерастворимом — отнятие электронов у тех анионов, которые находятся прианодной области. На катоде же появляется избыточный отрицательный заряд за счет скопившихся на нем электронов. К положительному аноду начинают движение противоположно заряженные анионы, а к катоду — катионы. При этом достигнув электродов они могут претерпевать определенные химические превращения.
Проходящий через электролит ток обычно постоянный, хотя иногда он может быть и переменным или изменяться по определенной функции. В любом случае, мы всегда сможем выделить катодный (восстановление) и анодный (окисление) процессы.
Электролиз не обязательно должен происходить только в водных растворах. Существуют также неводные электрохимические системы на основе органических (в основном апротонных) растворителей, солевых расплавов и даже твердых электролитов, однако их применение в промышленности для получения металлических покрытий ограничено, а в случае твердых электролитов — вообще невозможно.
В гальванике, исходя из вышеприведенной схемы, может быть три варианта организации процесса:1. Электролиз с растворимыми анодами. Металл анода растворяется и его ионы переходят в раствор, а на катоде эти же ионы восстанавливаются и осаждается металлическое покрытие. Примеры такого процесса — цинкование, меднение, никелирование и т.п.
2. Электролиз с нерастворимыми анодами. Анод не растворяется, на нем происходит побочная реакция, например, выделение кислорода. На катоде происходит восстановление металла, ионы которого подтягиваются из электролита. Происходит непрерывное снижение концентрации ионов металла в растворе.
3. Анодирование — получение оксидного покрытия на детали, завешенной в ванну анодом, на катоде идет выделение водорода.Устройство для проведения электролиза называется электролизером. Небольшой лабораторный электролизер принято называть ячейкой, в то время как промышленная установка будет называться гальванической ванной.
Схема простейшего электролизера (рисунок 1 и 2) всегда включает в себя:
• электролит, через который протекает электрический ток;
• катод(ы) — покрываемые детали (отрицательный электрический полюс, на котором происходит процесс принятия электронов — восстановления).
• Катод, на который наносится покрытие также может называться подложкой или основой, а покрытие на катоде — осадком;
• аноды — противоэлектроды (положительный электрический полюс, на котором происходит процесс отдачи электронов — окисления);
• источник электрического тока.
В случае нанесения анодного оксидного покрытия, например, на алюминии (процесс анодирования), покрываемые изделия находятся на аноде, а катоды выполняют роль противоэлектродов.
Электролизер может комплектоваться и дополнительным оборудованием:• нагреватели; • системы перемешивания; • системы фильтрации;• бортовые отсосы;• крышки;• датчики технологических параметров (температуры, рН, уровень, потенциал, концентрация компонентов и т.п.), дозаторы и другие средства автоматизации.
Рисунок 1 — Принципиальная схема электролизера
Рисунок 2 — Реальный электролизер (гальваническая ванна блестящего цинкования из щелочного цинкатного электролита).
Способ третий: медные монеты
Ингредиентами для изготовления такой батарейки своими руками являются:
- медные монеты;
- алюминиевая фольга;
- плотный картон;
- столовый уксус;
- провода.
Нетрудно догадаться, что электроды будут медные и алюминиевые, а в качестве электролита используется водный раствор уксусной кислоты.
Монеты для начала нужно очистить от окислов. Для этого их потребуется ненадолго опустить в уксус. Затем изготавливаем кружочки из картона и фольги по размеру монет, используя одну из них в качестве шаблона. Вырезаем кружки ножницами, картонные кладем на некоторое время в уксус: они должны пропитаться электролитом.
https://youtube.com/watch?v=msP0Opwz6t4
Затем из ингредиентов выкладываем столбик: сначала монету, затем – картонный кружок, кружок из фольги, снова монету и так далее, пока материал не иссякнет. Конечным элементом снова должна стать медная монета. К крайним монеткам можно заранее припаять провода. Если паять не хочется, то проводки прикладываются к ним, и вся конструкция плотно оборачивается скотчем.
В процессе работы этой батарейки, собранной своими руками, монеты придут в полную негодность, так что не стоит использовать нумизматический материал, представляющий культурную и материальную ценность.
История
В 1780 году Луиджи Гальвани обнаружил, что, когда два разных металла (например, медь и цинк) находятся в контакте, а затем оба одновременно касаются двух разных частей мускула лягушачьей ноги, чтобы замкнуть цепь, лягушачья нога контракты. Он назвал это « животным электричеством ». Нога лягушки, будучи датчиком электрического тока, была еще и электролитом (выражаясь языком современной химии).
Через год после того, как Гальвани опубликовал свою работу (1790), Алессандро Вольта показал, что лягушка не нужна, вместо этого использовал силовой детектор и пропитанную рассолом бумагу (в качестве электролита). (Ранее Вольта установил закон емкости C =QVс силовыми детекторами). В 1799 году Вольта изобрел гальваническую батарею, которая представляет собой группу гальванических элементов, каждая из которых состоит из металлического диска, слоя электролита и диска из другого металла. Он построил его полностью из небиологического материала, чтобы бросить вызов теории электричества животных Гальвани (а позже экспериментатор Леопольдо Нобили ) в пользу своей собственной теории контактного электричества металл-металл. Карло Маттеуччи, в свою очередь, сконструировал батарею полностью из биологического материала в ответ Вольте. Взгляд Вольта на контактное электричество характеризовал каждый электрод числом, которое мы теперь назвали бы работой выхода электрода. Эта точка зрения игнорировала химические реакции на границах раздела электрод-электролит, которые включают образование H 2 на более благородном металле в куче Вольта.
Хотя Вольта не понимал принципа действия батареи или гальванического элемента, эти открытия проложили путь для электрических батарей; Ячейка Вольты была названа вехой IEEE в 1999 году.
Примерно сорок лет спустя Фарадей (см . Законы электролиза Фарадея ) показал, что гальванический элемент, который теперь часто называют гальваническим элементом, был химическим по своей природе. Фарадей ввел в язык химии новую терминологию: электрод ( катод и анод ), электролит и ион ( катион и анион ). Таким образом, Гальвани ошибочно полагал, что источник электричества (или источник ЭДС, или место расположения ЭДС) находится в животном, Вольта ошибочно полагал, что это было в физических свойствах изолированных электродов, но Фарадей правильно определил источник ЭДС как химические реакции. на двух поверхностях раздела электрод-электролит. Авторитетная работа по интеллектуальной истории гальванической ячейки остается работой Оствальда.
В 1940 году Вильгельм Кениг высказал предположение, что объект, известный как багдадская батарея, может представлять технологию гальванических элементов из древней Парфии . Было показано, что реплики, наполненные лимонной кислотой или виноградным соком, производят напряжение. Однако нет уверенности в том, что это было его предназначение — другие ученые отмечали, что он очень похож на сосуды, которые, как известно, использовались для хранения пергаментных свитков.
Применение[править | править код]
- Гальванические элементы используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления, компьютерах.
- Аккумуляторы используются для запуска двигателей машин; возможно также и применение в качестве временных источников электроэнергии в местах, удалённых от населенных пунктов.
- Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
Нередко, химические источники тока применяются в составе батарей (батареек).
4. Напряжение на электролизере.
Для того, чтобы электрический ток прошел через электролизер, необходимо приложить определенное напряжение. При постоянной величине электрического тока I, чем выше сопротивление R в узлах электролизера, тем выше требуется напряжение U. Произведение U*I называется мощностью W, измеряемой в кВт. Произведение мощности на время (в часах) называется киловатт-часами и характеризует затраты электричества на проведение процесса. Следовательно, при прочих равных условиях, необходимо стремиться снизить напряжение на ванне.
Напряжение на работающем электролизере складывается из следующих величин:• Uреакции — напряжение, требуемое для прохождения целевых реакций (осаждение покрытия, растворение анода и т.д.). Более правильно — это сумма обратимого напряжения разложения (разность равновесных или стационарных потенциалов катода и анода в данном электролите), катодной и анодной поляризации ή;• Uтв проводники — напряжение, требуемое для прохождения электрического тока по твердым проводникам: покрываемым деталям, анодам, шинам, подвескам, проводам и т.д. • Uконтакты — падение напряжения во всех контактах: места подключения проводов к источнику тока, места контакта проводов с шинами, шины с подвеской или анодными крючками, подвески и покрываемых деталей, анодных крючков и анодов;• Uэлектролит — падение напряжения в электролите, определяющееся электропроводностью электролита;• Uдиафр — падение напряжения в анодных чехлах, диафрагмах, колоколах, барабанах.Общее сопротивление работающей гальванической ванны можно, таким образом, выразить формулой:
Uобщ=Uреакции+Uтв.проводники+Uконтакты+Uэлектролиты+Uдиафр
Как видно из формулы, чтобы снизить сопротивление на работающей ванне нужно:• использовать твердые проводники с минимальным сопротивлением и достаточным сечением. При прохождении по ним тока (при недостаточном сечении) они могут разогреваться, что дополнительно повысит их сопротивление.• своевременно чистить все перечисленные выше электрические контакты. Использовать максимально коррозионно-стойкие материалы.• своевременно корректировать электролит и соблюдать режим электролиза. При прохождении электрического тока через электролит его температура может расти, что увеличит его электропроводность, в отличие от твердых тел.• по возможности не использовать чехлы и диафрагмы (при цинковании, например, анодные чехлы будут лишними, а вот при никелировании на подвесках — незаменимыми).
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ: САМОДЕЛЬНАЯ БАТАРЕЯ
Каждому из нас знакомы химические источники тока различных типов и форм. Но как это часто случается, мы редко задумываемся о том, как устроен этот совершенно привычный и обыденный предмет. А между тем, появление первых химических источников тока, положило начало превращению электричества из лабораторной диковинки в нашего повседневного помощника.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока . Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток .
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов . Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления . Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода . Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Нормативные документы
Учитывая большое количество электроэлементов, для их буквенно-цифровых (далее БО) и условно графических обозначений (УГО) был разработан ряд нормативных документов исключающих разночтение. Ниже представлена таблица, в которой представлены основные стандарты.
Таблица 1. Нормативы графического обозначения отдельных элементов в монтажных и принципиальных электрических схемах.
| Номер ГОСТа | Краткое описание |
| 2.710 81 | В данном документе собраны требования ГОСТа к БО различных типов электроэлементов, включая электроприборы. |
| 2.747 68 | Требования к размерам отображения элементов в графическом виде. |
| 21.614 88 | Принятые нормы для планов электрооборудования и проводки. |
| 2.755 87 | Отображение на схемах коммутационных устройств и контактных соединений |
| 2.756 76 | Нормы для воспринимающих частей электромеханического оборудования. |
| 2.709 89 | Настоящий стандарт регулирует нормы, в соответствии с которыми на схемах обозначаются контактные соединения и провода. |
| 21.404 85 | Схематические обозначения для оборудования, используемого в системах автоматизации |
Следует учитывать, что элементная база со временем меняется, соответственно вносятся изменения и в нормативные документы, правда это процесс более инертен. Приведем простой пример, УЗО и дифавтоматы широко эксплуатируются в России уже более десятка лет, но единого стандарта по нормам ГОСТ 2.755-87 для этих устройств до сих пор нет, в отличие от автоматических выключателей. Вполне возможно, в ближайшее время это вопрос будет урегулирован. Чтобы быть в курсе подобных нововведений, профессионалы отслеживают изменения в нормативных документах, любителям это делать не обязательно, достаточно знать расшифровку основных обозначений.
13 Хромирование авто.
Еще одно заблуждение – хромирование авто это всегда гальваника. Совсем нет. Почти всегда под хромированием авто подразумевается краска. Просто она выглядит как хром. Но никакой связи с гальваническим хромом не имеет. Как только в хромированный таким образом диск попадет небольшой камешек – краска сразу отлетит.
Гальванический хром имеет огромную твердость и износостойкость. Никакой камешек ему нипочем.
Говоря о цене, вот Вам пример. Покрыть гальваническим хромом 4 диска авто будет стоить от 100 т.р., когда как покрыть хромом (краской) стоит 5-10 т.р. Ощутимая разница.
Если Вам автосервис предлагает хромирование, уточните, как они его производят. Скорей всего это будет распыление из шланга или балончика.
В России менее 10 гальванических предприятий профессионально занимаются хромированием авто и мото. Повторюсь, это очень дорого. Рестравраторы платят от 1 млн рублей за такую роскошь.
Об этой статье
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 29 человек(а). Количество просмотров этой статьи: 21 845.
Категории: Дом и сад
English:Make a Homemade Battery
Español:hacer una batería casera
Português:Fazer Uma Pilha Caseira
Italiano:Costruire una Batteria fatta in Casa
Deutsch:Eine Batterie selber bauen
Français:fabriquer soi‐même une pile
Bahasa Indonesia:Membuat Baterai Rumahan
العربية:صنع بطارية منزلية الصنع
Nederlands:Zelf een batterij maken
한국어:집에서 건전지 만드는 방법
日本語:自家製電池を作る
Печать
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
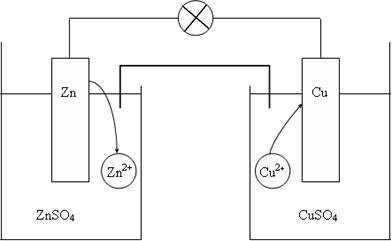
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
- Первый слой — это катод, представляющий собой смесь оксида марганца (MnO₂) и графита. Этот материал находится в контакте с металлом положительной клеммы. Графит добавляется для улучшения проводимости смеси и увеличения плотности энергии.
- Затем идет сепаратор — слой пористого материала, который образует барьер, предотвращающий прямой контакт анодного и катодного материалов друг с другом. В процессе производства на сепаратор распыляется щелочной электролит — гидроксид калия.
- С другой стороны барьера находится анод, который представляет собой пасту, изготовленную из цинкового порошка (Zn), а также желирующего агента. Желирующий агент поддерживает цинк во взвешенном состоянии, чтобы он не накапливался в одном месте.






