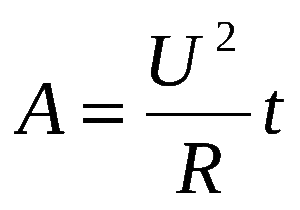Обсуждение с заказчиком технического задания и подготовка электролита.
Изделие нельзя просто начать покрывать, как только его привез клиент. Обязательно требуется техническое задание (ТЗ) на гальваническое покрытие. Оно составляется исходя из целей клиента. Что он хочет в конечном итоге получить? Его цель – красивый сувенир, который будет лежать на полке – выбираем хром или никель. Цель – защита стального изделия от коррозии на 20 лет – выбираем цинк. Цель – хорошая электропроводность шины в электротехническом шкафу – наш вариант олово/серебро/никель. И т.д.
Здесь же требуется оговорить толщину покрытия. Чем больше толщина — тем лучше покрытие защищает изделие, но и цена покрытия выше.
Если ТЗ на гальванику у Заказчика не имеется — достаточно словестного описание, какие свойства необходимы для изделия. Или в каких условяих будет работать деталь. Грамотный менеджер сам подберет гальваническое покрытие. Вы можете позвонить в наш офис для бесплатной консультации.
Подготовка электролита. Гальванические предприятия работают на заранее приготовленных штатных электролитах. Растворы надежны, проверены и подходят для большинства заказов. Но в ряде случаев требуется развести персональный раствор для достижения определенных характеристик покрытия. Перед каждым запуском нового заказа в работу инженеры анализируют, подойдет ли штатный раствор или нужен персональный.
Разновидности гальванических элементов
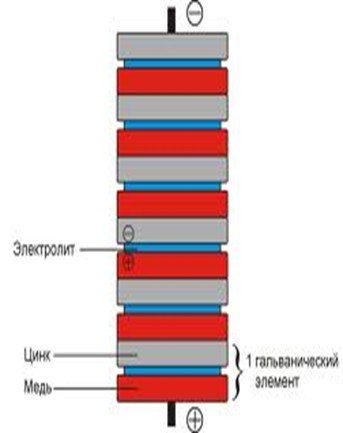
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Классификация по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
|---|---|---|---|
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. Обычно именно их и называют словом «батарейка». Попытка зарядить первичный элемент питания может привести к порче и утечке щёлочи или других веществ, находящихся в нём. Самые популярные. | Выше ёмкость и/или дешевле. Меньше саморазряд. | Одноразовость применения. |
| Вторичные | Аккумуляторы. В отличие от первичных, реакции в них обратимы, поэтому они способны преобразовывать электрическую энергию в химическую, накапливая её (заряд), и выполнять обратное преобразование, отдавая электрическую энергию потребителю (разряд). Для распространённых аккумуляторов число циклов заряд-разряд обычно равно примерно 1000 и заметно зависит от условий эксплуатации. | Многократность применения, перезаряжаемые. | Ниже ёмкость и/или дороже. Сильнее саморазряд. |
Оборудование и материалы
Нанесение гальванических покрытий на различные металлы требует использования соответствующего оборудования и расходных материалов. Для хромирования, цинкования, а также для покрытия обрабатываемых деталей другими металлами используется однотипное гальваническое оборудование. Различия при выполнении таких процессов будут заключаться только в составе используемого электролита, его температуре и других режимах выполнения обработки.
Обработка металла методом гальваники выполняется с использованием такого оборудования, как:
- гальванические ванны, в которые заливается электролитический раствор, помещаются аноды и обрабатываемое изделие;
- источник постоянного тока, оснащенный регулятором выходного напряжения;
- нагревательное устройство, при помощи которого электролитический раствор доводят до требуемой рабочей температуры.
Гальваническая ванна с механизмом покачивания
Для выполнения гальваники также необходимы анодные пластины, которые могут быть изготовлены из различных металлов. Назначение таких пластин состоит не только в подаче электрического тока в электролит, а также в равномерном распределении тока по поверхности обрабатываемого изделия, но и в том, чтобы восполнять убыль наносимого на деталь металла, активно расходуемого из состава электролита.
Различные виды гальванических покрытий наносятся с использованием электролитических растворов с разным химическим составом. Для приготовления таких растворов применяются опасные химические вещества, поэтому храниться они должны в герметичных стеклянных емкостях с притертыми крышками. Все химические реагенты, из которых готовится электролитический раствор для гальваники, должны отмеряться в точных количествах, поэтому для выполнения такой процедуры необходимо использовать электронные весы.
Ручная линия гальванопластики драгоценных металлов
Любая линия для выполнения гальваники металлов или простейшее гальваническое оборудование должны устанавливаться в помещениях, оснащенных эффективной вентиляционной системой. Необходимо также очень ответственно отнестись к личной безопасности специалиста, обслуживающего оборудование для гальваники. Все работы, связанные с гальваникой, надо выполнять в респираторе и защитных очках, в плотных резиновых перчатках, клеенчатом фартуке и обуви, способной защитить кожу ног от ожогов. Если этот процесс выполняется в домашних условиях, при этом вы еще в полной мере не знаете, что такое гальванизация, то следует заранее внимательно изучить специальную литературу или посмотреть обучающее видео на эту тему.
Принцип действия
Наипростейший медно-цинковый столб собирается из 2 электродных пластин, расположенных в растворе электролита. В этом случае, погружая электролит в пространство между металлами, Вы создаете разницу потенциалов.
Внимание! Если Вы погрузите медные и цинковые пластины в раствор соли, то возникнет разница потенциалов, составляющая приблизительно 1 вольт, тогда как каждый элемент, отдельно взятый в независимости от габаритов, испытывает напряжение в 1 вольт. Помните, что мощность пластин в электролите зависит от площади действия
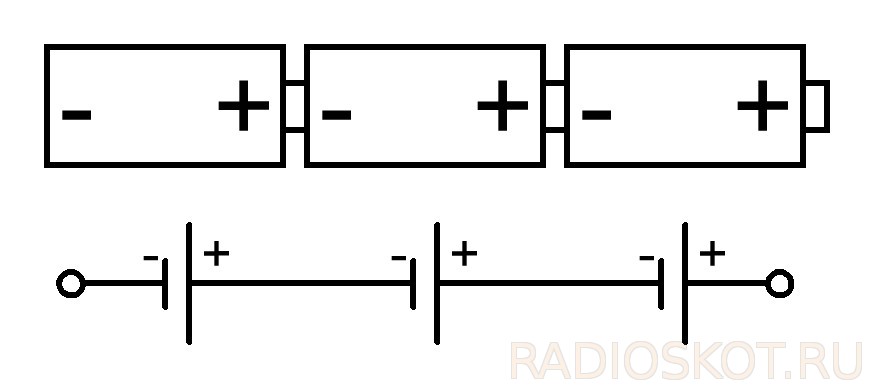
Для создания более высокого напряжения или мощности этих элементов заводские батарейки делают в виде последовательно соединённых, количество увеличивают до того, как получат нужное напряжение.
Заводская схема конструкции
Условные графические обозначения ЭРЭ в схемах электрических, радиотехнических и автоматизации
65 — гнездо разъемною контактного соединения,
66 — контакт разборного соединения например с помощью зажима
67 — контакт неразборного соединения, например осуществленного пайкой
68 — выключатель кнопочный однополюсный нажимной с Замыкающим контактом самовозвратом
69 — контакт коммутационного устройства размыкающий, общее обозначение
70 — контакт коммутационного устройства (выключателя, реле) замыкающий, общее обозначение. Выключатель однополюсный.
71 — контакт коммутационного устройства переключающий, общее обозначение. Однополюсный переключатель на два направления.
72— контакт переключающий трехпозиционный с нейтральным положением
73 — контакт замыкающий без самовозврата
74 — выключатель кнопочный нажимной с размыкающим контактом
75 — выключатель кнопочный вытяжной с замыкающим контактом
76 — выключатель кнопочный нажимной с возвратом кнопки,
77 — выключатель кноночный вытяжной с размыкающим контактом
78 — выключатель кнопочный нажимной с возвратом посредством вторичного нажатия кнопки,
79 — реле электрическое с замыкающим размыкающим и переключающим контактами,
80 — реле поляризованное на одно направление тока в обмотке с нейтральным положением
81 — реле поляризованное на оба направления тока в обмотке с нейтральным положением
82 — реле электротепловое без самовозврата, с возвратом посредством вторичного нажатия кнопки,
83- разъемное однополюсное соединение
84 — гнездо пятипроводного контактного разъемного соединения,
85 штырь контактного разъемного коаксиального соединения
86 — гнездо контактною соединения
87 — штырь четырехпроводного соединения,
88 гнездо четырехпроводного соединения
89 — перемычка коммутационная размыкающая цепь
Любые электрические цепи могут быть представлены в виде чертежей (принципиальных и монтажных схем), оформление которых должно соответствовать стандартам ЕСКД. Эти нормы распространяются как на схемы электропроводки или силовых цепей, так и электронные приборы. Соответственно, чтобы «читать» такие документы, необходимо понимать условные обозначения в электрических схемах.
Отличия щелочных и солевых батареек
Солевые и алкалиновые элементы во многом аналогичны по конструкции. Она в обоих случаях включает 2 электрода и электролит. Различие состоит в типе анода и составе электролита.
Конструктивные отличия определяют существенную разницу в характеристиках. Эксплуатационный срок алкалиновых элементов в 2-3 раза выше в сравнении с солевыми батарейками. К тому же ввиду меньшего внутреннего сопротивления щелочные батарейки применимы в качестве силовых энергоэлементов. С ростом нагрузки их удельная емкость возрастает. Солевые батарейки уступают по этому показателю в 2-10 раз. В холоде щелочные батарейки более стабильны, чем солевые. Риск утраты герметичности корпуса понижен. Названные преимущества обуславливают большую стоимость в сравнении с солевыми батарейками.
При этом щелочные и солевые элементы идентичны по принципу функционирования. К тому же совпадает диапазон напряжения (1,5-12 В). Поэтому они подходят для одних устройств. Оба типа относят к категории марганцево-цинковых энергоэлементов. Они встречаются в аналогичных форм факторах.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ: САМОДЕЛЬНАЯ БАТАРЕЯ
Каждому из нас знакомы химические источники тока различных типов и форм. Но как это часто случается, мы редко задумываемся о том, как устроен этот совершенно привычный и обыденный предмет. А между тем, появление первых химических источников тока, положило начало превращению электричества из лабораторной диковинки в нашего повседневного помощника.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока . Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
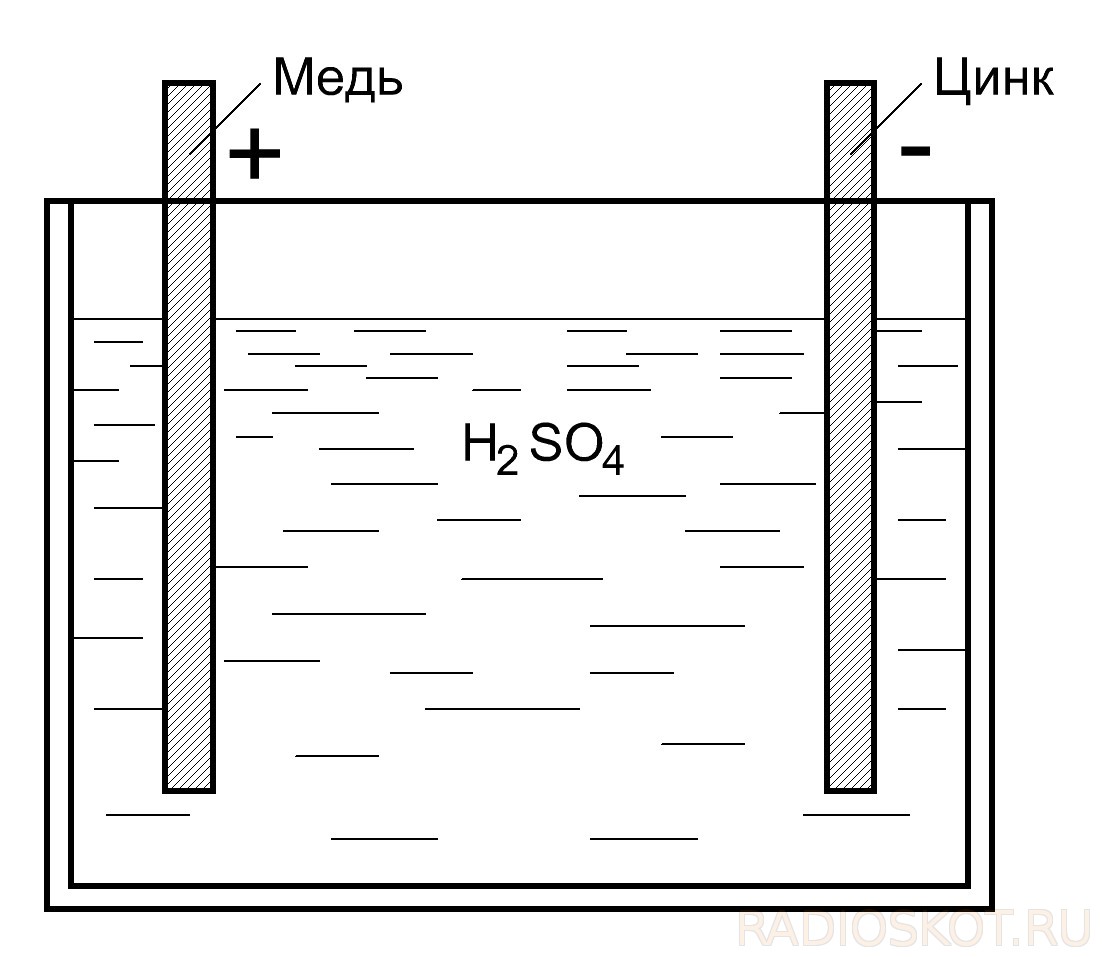
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток .
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов . Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.

Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.

Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления . Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода . Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Условные графические обозначения ЭРЭ в схемах электрических, радиотехнических и автоматизации
1— транзистор структуры р- n-р в корпусе, общее обозначение;
2— транзистор структуры п-р-п в корпусе, общее обозначение,
3 — транзистор полевой с p-n-переходом и п каналом,
4 — транзистор полевой с p-n-переходом и р каналом,
5 — транзистор однопереходный с базой п типа, б1, б2 — выводы базы, э — вывод эмиттера,
7 — диод выпрямительный,
8 — стабилитрон (диод лавинный выпрямительный) односторонний,
9 — диод тепло-электрический,
10 — тиристор диодный, стираемый в обратном направлении;
11 — стабилитрон (диодолавинный выпрямительный) с двусторонней проводимостью,
12 — тиристор триодный.
14 — переменный резистор, реостат, общее обозначение,
Читать также: Основные типы подшипников скольжения
15 — переменный резистор,
16 — переменный резистор с отводами,
17 — построечный резистор-потенциометр;
18 — терморезистор с положительным температурным коэффициентом прямого нагрева (подогрева),
20 — конденсатор постоянной емкости, общее обозначение,
21 — конденсатор постоянной емкости поляризованный;
22 — конденсатор оксидный поляризованный электролитический, общее обозначение;
23 — резистор постоянный, общее обозначение;
24 — резистор постоянный с номинальной мощностью 0, 05 Вт;
25 — резистор постоянный с номинальной мощностью 0, 125 Вт,
26 — резистор постоянный с номинальной мощностью 0, 25 Вт,
27 — резистор постоянный с номинальной мощностью 0, 5 Вт,
28 — резистор постоянный с номинальной мощностью 1 Вт,
29 — резистор постоянный с номинальной мощностью рассеяния 2 Вт,
30 — резистор постоянный с номинальной мощностью рассеяния 5 Вт;
31 — резистор постоянный с одним симметричным дополнительным отводом;
32 — резистор постоянный с одним несимметричным дополнительным отводом;
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Половина реакции и условности
Полуячейка содержит металл в двух степенях окисления . Внутри изолированной полуячейки происходит окислительно-восстановительная (окислительно-восстановительная) реакция, которая находится в химическом равновесии , условие, которое символически записывается следующим образом (здесь «M» представляет катион металла, атом, который имеет дисбаланс заряда из-за потеря » n » электронов):
- M n + (окисленные частицы) + n e — ⇌ M (восстановленные частицы)
Гальванический элемент состоит из двух полуэлементов, так что электрод одного полуэлемента состоит из металла A, а электрод другого полуэлемента состоит из металла B; Таким образом, окислительно-восстановительные реакции для двух отдельных полуэлементов выглядят следующим образом:
- А п + + п е — ⇌ А
- B m + + m e — ⇌ B
Общая сбалансированная реакция
- m A + n B m + ⇌ n B + m A n +
Другими словами, атомы металла одной полуячейки окисляются, а катионы металлов другой полуячейки восстанавливаются. Разделив металлы на две полуячейки, их реакцией можно управлять таким образом, чтобы обеспечить перенос электронов через внешнюю цепь, где они могут выполнять полезную работу .
Электроды соединены металлической проволокой, чтобы проводить электроны, участвующие в реакции.
- В одной полуячейке растворенные катионы металла-B объединяются со свободными электронами, которые доступны на границе раздела между раствором и электродом металла-B; эти катионы тем самым нейтрализуются, вызывая их выпадение в осадок из раствора в виде отложений на металлическом электроде B, процесс, известный как гальваническое покрытие .
- Эта реакция восстановления заставляет свободные электроны по всему электроду металла-B, проволоке и электроду металла-A втягиваться в электрод металла-B. Следовательно, электроны отталкиваются от некоторых атомов электрода металла-A, как если бы катионы металла-B вступали в реакцию непосредственно с ними; эти атомы металла-A становятся катионами, которые растворяются в окружающем растворе.
- По мере продолжения этой реакции в полуячейке с электродом металла-A образуется положительно заряженный раствор (потому что в нем растворяются катионы металла-A), в то время как в другой полуячейке образуется отрицательно заряженный раствор (поскольку катионы металла-B выпадать из него в осадок, оставляя после себя анионы); неослабевая, этот дисбаланс в ответственности остановит реакцию. Растворы полуэлементов соединены солевым мостиком или пористой пластиной, которая позволяет ионам переходить от одного раствора к другому, что уравновешивает заряды растворов и позволяет реакции продолжаться.
По определению:
- Анод представляет собой электрод , в котором окисление (потеря электронов) имеет место (металл-электрод); в гальваническом элементе это отрицательный электрод, потому что при окислении электроны остаются на электроде. Эти электроны затем проходят через внешнюю цепь к катоду (положительному электроду) (в то время как при электролизе электрический ток движет поток электронов в противоположном направлении, а анод является положительным электродом).
- Катодом является электрод , где уменьшение (прирост электронов) имеет место (металл-B электрод); в гальваническом элементе это положительный электрод, поскольку ионы восстанавливаются, забирая электроны с электрода и снимая пластину (в то время как при электролизе катод является отрицательным полюсом и притягивает положительные ионы из раствора). В обоих случаях оператор « кот hode привлекает кошек ионов» истинно.
Гальванические элементы по своей природе вырабатывают постоянный ток . Клетка Уэстон имеет анод , состоящий из кадмия , ртути амальгамы , и катод , состоящий из чистой ртути. Электролит представляет собой (насыщенный) раствор сульфата кадмия . Деполяризатор представляет собой пасту из сульфата ртути. Когда раствор электролита насыщен, напряжение ячейки очень воспроизводимо; следовательно, в 1911 году он был принят в качестве международного стандарта для напряжения.
Батарея — это набор гальванических элементов, которые соединены вместе и образуют единый источник напряжения. Например, типичная свинцово-кислотная батарея на 12 В имеет шесть гальванических элементов, соединенных последовательно с анодами, состоящими из свинца, и катодами, состоящими из диоксида свинца, оба погружены в серную кислоту. В больших аккумуляторных , например, в телефонной станции, обеспечивающей питание телефонов пользователей центрального офиса, ячейки могут быть подключены как последовательно, так и параллельно.
Гальваническая батарея
Первая самая мощная в мире гальваническая батарея была построена в 1802 г. в Петербурге В. В. Петровым.
|
Схема автоматического электрометрического газоанализатора.| Схематическое изображение газовой батареи. |
Цинковый электрод, являющийся анодом гальванической батареи, может при работе подвергаться гальваническому и химическому растворению, а также и коррозии. Эти явления могут происходить при разомкнутой цепи. Для уменьшения растворения цинкового электрода его амальгамируют. Градуировку прибора производят пропусканием газовых смесей с различным содержанием кислорода и регистрацией показаний гальванометра.
Если для соединения двух пластин гальванической батареи, состоящей из одной пары металлов, служит обыкновенная проволока небольшой длины, то никакими ухищрениями экспериментатору не удается получить от этой проволоки электрического удара, но если взять для этой цели обмотку электромагнита, то всякий раз при размыкании соединения с гальванической батареей ощущается удар… Одновременно наблюдается другое, давно известное ученым явление, а именно: в месте разъединения проскакивает яркая электрическая искра ( курсив мой.
|
Схема автоматического электрометрического газоанализатора.| Схематическое изображение газовой батареи. |
Цинковый электрод, являющийся анодом гальванической батареи, может при работе подвергаться гальваническому и химическому растворению, а также и коррозии. Эти явления могут происходить при разомкнутой цепи. Для уменьшения растворения цинкового электрода его амальгамируют. Градуировку прибора производят пропусканием газовых смесей с различным содержанием кислорода и регистрацией показаний гальванометра.
Создав огромную для своего времени гальваническую батарею, В. В. Петров в 1802 г. обнаружил, что при разведении друг от друга угольных электродов, через которые шел ток, цепь не разрывалась и между электродами возникало ослепительное пламя электрической дуги.
Создав огромную для своего времени гальваническую батарею, В. В. Петров в 1802 г. обнаружил, что при разведении друг от друга угольных электродов, через которые шел ток, цепь не разрывалась и между электродами возникало ослепительное пламя электрической дуги.
Широко известная потребителям Крона-ВЦ представляет собой воздушно-цинковую сухую гальваническую батарею с щелочным электролитом.
Применяют в качестве деполяризатора в сухих гальванических батареях и белителя расплавленной стекольной массы.
Промышленность выпускает сухие гальванические элементы и гальванические батареи для самых разнообразных областей техники. Назначение элемента или батареи указывается в паспорте первой буквой или сочетанием нескольких букв, стоящих перед буквами, обозначающими тип батареи. Первой цифрой указывается начальное напряжение, а последней цифрой — емкость в амтер-часах или продолжительность работы в часах.
|
Схемы автоматического смещения. |
В качестве источника постоянного тока может использоваться гальваническая батарея, аккумулятор или выпрямитель.
Если применять большую силу тока, то гальваническую батарею заменяют стабилизатором тока от сети, который дает колебания силы тока в пределах 0 1 %, или же амперостатом.
Если применять большую силу тока, то гальваническую батарею заменяют стабилизатором тока от сети, который дает колебания силы тока а пределах 0 1 %, или же амперостатом.
Основные характеристики батареек
С терминологией разобрались, теперь посмотрим, какими бывают батарейки и чем они отличаются друг от друга.
Форм-фактор
Современные батарейки – и гальванические элементы, и батареи на их основе – выпускаются в различных форм-факторах. Наиболее распространенные – цилиндрические и дисковые. Некоторые батареи могут иметь прямоугольную форму.
Наиболее популярные типоразмеры гальванических элементов и батарей
Что касается аккумуляторов, то они могут в точности повторять форму и размер гальванических элементов, но могут быть и оригинальной формы. На фото ниже слева направо можно увидеть цилиндрический аккумулятор формата АА на 3.7 вольта (но не на 1.5, как обычная пальчиковая батарейка), дисковый, в точности повторяющий форму литиевого гальванического элемента и дисковый оригинальной формы (таблетка).
Аккумуляторы, как и гальванические элементы, могут выпускаться в разных форм-факторах
Типы батареек
По типу электролита и материалу электродов гальванические элементы можно разделить на:
Солевые. Элементы этого типа имеют электроды на основе марганца и цинка, в качестве электролита используется соль – хлорид аммония. Устройства отличаются низкой электрической емкостью и недолговечностью, но имеют небольшую стоимость.
Щелочные. В элементах этого типа для электродов используются те же материалы, но в качестве электролита применяется щелочь – гидроксид калия. Батарейки этого типа имеют повышенную емкость и повышенный срок службы. Они способны развивать высокие питающие токи, но стоят в несколько раз дороже солевых элементов. Нередко щелочные батарейки называют алкалиновыми или алкалайновыми.
Литиевые. Анод этих элементов изготовлен на основе лития, катод же и электролит подбираются в зависимости от необходимого выходного напряжения, которое может варьироваться от 1.5 до 3.0 В в зависимости от назначения источника тока. Литиевые гальванические элементы (не путать с литиевыми аккумуляторами) имеют высокую емкость, долговечны (работают годами), но дороже щелочных.
Литиевая пальчиковая батарейка (гальванический элемент)
Серебряно-цинковые. Эти батарейки обычно выпускаются в форме таблетки. Их можно встретить в наручных часах и подобной малогабаритной экономичной технике. Это компактный и долговечный источник тока, но стоит он 1довольно дорого (относительно емкости) и не обладает большой электрической емкостью.
Выходное напряжение
Выходное напряжение всех солевых и щелочных гальванических элементов составляет 1.5 В. Серебряно-цинковые «таблетки» выдают те же 1.5 В. Литиевые элементы, как указывалось выше, в зависимости от типа катода и электролита могут иметь на выходе напряжение от 1.5 до 3.0 В.
Никель-кадмиевые (Ni-Cd) и никель-металлогидридные (Ni-MH) перезаряжаемые батарейки (аккумуляторы) выдают 1.2 В. Этот тип аккумуляторов наиболее популярен и часто используется в качестве замены пальчиковых (формат АА) и мизинчиковых (ААА) гальванических элементов.
Никель-кадмиевые (слева) и никель-металлогидридные аккумуляторы формата АА и ААА
У никель-цинковых (Ni-Zn) аккумуляторов на выходе 1.6 В.
В последнее время широкое распространение получили литий-ионные и литий-железо-фосфатные аккумуляторы. Первые выдают 3.7 В, вторые – 3.2 В. Они могут иметь тот же форм-фактор, что и солевые или щелочные батарейки, но из–за разницы выходных напряжений одни заменить другими нельзя.
Выбираем зарядное устройство
И в завершение посмотрим, какие зарядные устройства выбирают пользователи приборов, работающих от перезаряжаемых батареек. Таблица была составлена по степени популярности последних.
Рейтинг зарядных устройств по популярности
| Рейтинг | Внешний вид | Модель | Производитель | Тип аккумуляторов | Типоразмер аккумуляторов | Количество отсеков (независимых каналов) | Дополнительные функции | Цена, руб. | Где купить |
| 1 | Nitecore D4 | ТМ Nitecore | IMR/Li-ion, Ni-MH/Ni-Cd | AA (R6), ААA (R03), AAAA, С (R14), 26650, 22650, 18650, 10440, 14500, 16340, CR123A, 17670, 17500, 18490, 18350 | 4 | Автоопределение типа, отображение состояния на ЖК-дисплее, определение емкости, восстановление, защита от переполюсовки, перезаряда, переразряда, питание от прикуривателя авто | 2 200 | Я.Маркет | |
| 2 |
|
Liitokala Lii-500 | Liitokala | Li-ion, Ni-MH | 18650, 18490, 18350, 17670, 17500, 17335, 16340 (RCR123), 14500, 10440, 26650, 22650, 26500, A, AA, AAA, SC | 4 | Автоопределение типа, отображение состояния на ЖК-дисплее, функция тестирования, восстановление, защита от переполюсовки, перезаряда, переразряда, порт USB 5 В/1А | 2 700 | Я.Маркет |
| 3 |
|
Palo P10 | Palo | NI-MH, NI-CD | AA, AAA | 8 | Светодиодная индикация заряда, фиксированный зарядный ток (200 или 180 мА), низкая стоимость, попарная зарядка, автоотключение пары по окончании зарядки | 900 | |
| 4 |
|
Opus BT-C3100 v2.2 | Opus | Ni-Cd, Ni-MH и Li-Ion | АА, ААА, С (R14), 10440, 16340, 14500, 17500, 17335, 17500, 18490, 17670, 18650, 22650, 26650 | 4 | Автоопределение, заряд / разряд / тестирование, отображение состояния на ЖК-дисплее, программированние тока заряда и дозаряда, дежим капельной дозарядки, восстановление | 2 800 | Я.Маркет |
| 5 |
|
SkyRC MC3000 | SkyRC | NiMh, NiCd, NiZn, Eneloop, Lithuim-Ion, Lilo4.35, LiFeP04 | AA, AAA, C, D, SC, AAAA, 18650, 14500, 16340, 32650, 14650, 17670, 10440, 18700, 18350, RCR123, 18500, 18490, 25500, 13500, 13450, 16650, 22650, 17500, 10340, 17650, 10500, 26500, 12340, 12500, 12650, 14350, 14430, 16500, 17350, 20700, 21700, 22500, 32600 | 4 | Автоопределение типа, отображение состояния на ЖК-дисплее, удаленный контроль по Bluetooth 4.0, восстановление, защита от переполюсовки, перезаряда, переразряда, контроль температуры, порт USB 5 В/2.1А, питание от бортовой сети, максимальный зарядный ток до 3 А | 7 000 | Я.Маркет |