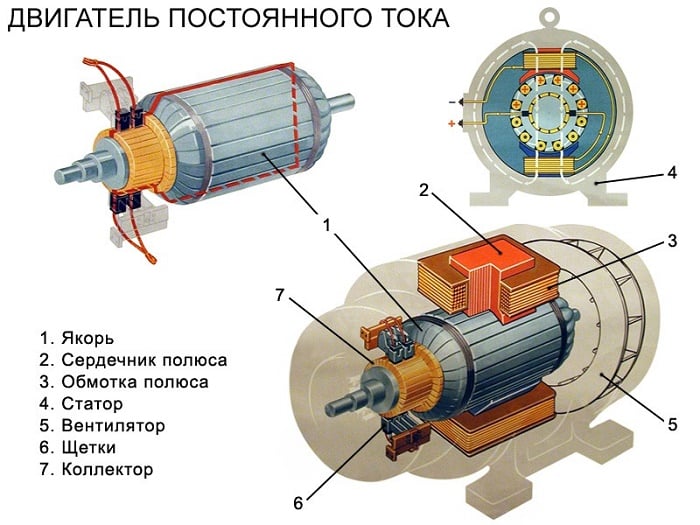
Взаимодействие свободных протонов с обычным веществом
Хотя протоны имеют сродство к противоположно заряженным электронам, это взаимодействие с относительно низкой энергией, поэтому свободные протоны должны потерять достаточную скорость (и кинетическую энергию ), чтобы стать тесно связанными и связанными с электронами. Протоны высоких энергий, пересекая обычную материю, теряют энергию из-за столкновений с атомными ядрами и из-за ионизации атомов (удаления электронов) до тех пор, пока они не замедлятся достаточно, чтобы быть захваченными электронным облаком в нормальном атоме.
Однако при такой ассоциации с электроном характер связанного протона не меняется, и он остается протоном. Притяжение свободных протонов низкой энергии к любым электронам, присутствующим в нормальном веществе (например, электронам в нормальных атомах), заставляет свободные протоны останавливаться и образовывать новую химическую связь с атомом. Такая связь происходит при любой достаточно «холодной» температуре (то есть сравнимой с температурами на поверхности Солнца) и с любым типом атома. Таким образом, при взаимодействии с любым типом нормального (неплазменного) вещества низкоскоростные свободные протоны не остаются свободными, а притягиваются к электронам в любом атоме или молекуле, с которыми они вступают в контакт, заставляя протон и молекулу объединяться. О таких молекулах говорят, что они « протонированы », и химически они представляют собой просто соединения водорода, часто положительно заряженные. Часто в результате они становятся так называемыми кислотами Бренстеда . Например, протон, захваченный молекулой воды в воде, превращается в гидроксоний , водный катион H3О+.
Нуклонная модель атома
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной, модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи «кирпичиками», из которых строится ядро, протоны и нейтроны получили общее название — нуклоны.
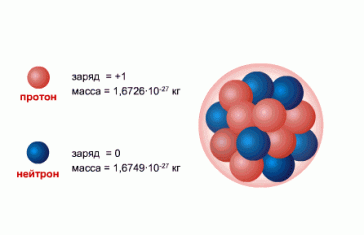
Нуклоны — общее название для составляющих атомное ядро протонов и нейтронов.
В рамках нуклонной теории о строении ядра атома ему было дано следующее определение:
Атомное ядро — центральная часть атома, состоящая из протонов и нейтронов.
Виды нуклонов:
- Протон (от protos — первый, обозначается как p или p+) — стабильная элементарная частица, ядро атома водорода. Заряд протона положительный, по модулю он равен заряду электрона: ep = 1.6∙10−19 Кл. Масса протона: mp = 1.6726231∙10−27 кг = 1.007276470 а. е. м. При расчетах часто используют округленное до целых значение: 1 а. е. м.
- Нейтрон (от лат. neuter — ни тот, ни другой, обозначается как n) — элементарная частица, не имеющая заряда, т. е. нейтральная. Масса нейтрона почти равна (незначительно больше) массе протона: mn = 1.6749286∙10−27 кг=1.0008664902 а. е. м. При расчетах также используют округленное до целых значение: 1 а. е. м.
Массовое число — общее число нуклонов в ядре. Обозначается как A.
Зарядовое число — число протонов в ядре. Обозначается как Z. Зарядовое число всегда соответствует порядковому номеру элемента в периодической таблице Менделеева.
Ядро любого химического в общем виде обозначается так:
A.ZX
где X — символ химического элемента, Z — число протонов в ядре (порядковый номер элемента в периодической таблице Менделеева), A — массовое число.
Массовое число определяется как сумму протонов и нейтронов, содержащихся в ядре атома:
A=Z+N
N – число нейтронов в ядре.
Пример №1. Пользуясь периодической системой элементов Д.И. Менделеева, определите число протонов и число нейтронов в ядрах атомов серы.
Взглянем на периодическую систему Менделеева и найдем серу:
Порядковый номер серы — 16. Следовательно, зарядовое число, или количество протонов в ядре атома серы — 16. Массовое число составляет 32,066 а. е. м. Округлим до целых и получим 32. Количество нейтронов найдем как разность массового и зарядового чисел:
N=A−Z=32−16=16
Нейтроны, изотопы и радиоактивность
Частица, которая находится в ядре атома — нейтрон на 0,2% больше протона. Вместе они составляют 99,99% всей массы одного и того же элемента могут иметь различное количество нейтронов. Когда ученые ссылаются на атомную массу, они имеют в виду среднюю атомную массу. Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда он встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса для углерода усредняется до 12,011.
Когда атомы имеют различное количество нейтронов, их называют изотопами. Ученые нашли способы добавления этих частиц в ядро для создания больших изотопов. Теперь добавление нейтронов не влияет на заряд атома, так как они не имеют заряда. Однако они увеличивают радиоактивность атома. Это может привести к очень неустойчивым атомам, которые могут разряжать высокие уровни энергии.
А что такое электрический ток?
Нет ничего проще! Поток электронов – вот что такое электроток. Как река – это течение триллионов и биллионов молекул воды по руслу, так и электрический ток – это течение миллиардов электронов по металлическому проводу. Все металлы очень хорошо проводят ток
Это отличительное свойство металлов, на которое ученые давно обратили внимание. Сегодня в кристаллической решетке металла мы умеем организовывать организованное течение мириадов элементарных частичек под названием электроны
Греки добывали чуть-чуть электричества, натирая шерстью янтарь. У нас же теперь – целые электростанции, которые занимаются производством электроэнергии. Уйму тока дают!
Короче говоря, заряд электрона – это некое свойство, которое характеризуется… чем? Ясно, чем характеризуется масса. Инертностью! Чем массивнее тело, тем труднее его разгонять. Попробовали потолкать – ого! тяжеленное! А заряд как обнаружить?
А заряд проявляет себя тем, что он притягивается к другому заряду – противоположному.
Существуют два вида зарядов – положительный и отрицательный. Ничего положительного и отрицательного в бытовом смысле в них нет, они не хорошие и не плохие, просто их так назвали когда-то да и все. Обозначают положительный заряд знаком плюс – «+», а отрицательный знаком минус – «-». Эти знаки вы тыщу раз видели на разных батарейках. А если не видели, сходите да посмотрите. Мне кажется, лучше всего попробовать выломать батарейку из папиных часов с помощью молотка и отвертки.
Электрон является носителем отрицательного заряда, а протон – положительного. Разноименные заряды притягиваются друг к другу, одноименные отталкиваются. Это прекрасно видно на рисунке.
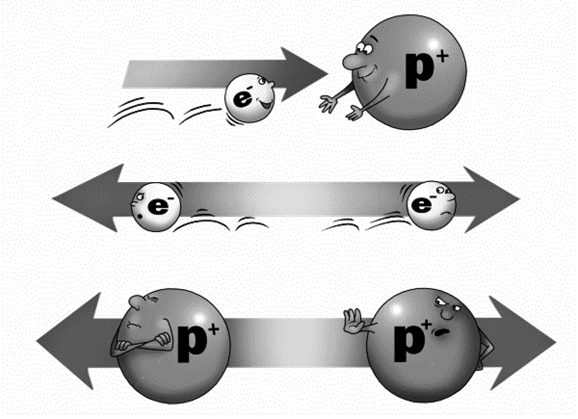
Притяжение и отталкивание электрических зарядов.
Вот так мы и к протону незаметно перешли. Посмотрим-ка на него внимательно.
Если электрон маленький, легонький и электроотрицательный (минус), то протон большой, тяжелый и электроположительный (плюс). Полная противоположность! При этом протон и электрон притягиваются друг к другу.
Что такое атом?
Мы знаем, что атом считается самой маленькой частицей, поскольку это фундаментальная единица, из которой состоит материя. Сам этот атом имеет 3 основные субатомные частицы, которые известны как электрон, протон и нейтрон.
Несколько атомов образуют молекулу, а атомы внутри молекулы связаны химическими связями. Электрический заряд атома поддерживает связь между атомами в молекуле. Среди электрона, протона и нейтрона электроны и протоны заряжены отрицательно и положительно соответственно, а нейтроны — нейтрально заряженные частицы.
Электроны и протоны обладают разными свойствами и находятся в разных местах внутри атома. Следовательно, есть основные различия между электроном и протоном, которые мы и обсудим в этой статье.
Антипротон
CPT-симметрия накладывает сильные ограничения на относительные свойства частиц и античастиц и, следовательно, открыта для строгих испытаний. Например, заряды протона и антипротона должны в сумме равняться нулю. Это равенство было проверено до одной части в10 8 . Равенство их масс также было проверено лучше, чем одна часть в10 8 . Удерживая антипротоны в ловушке Пеннинга , было проверено равенство отношения заряда к массе протонов и антипротонов с точностью до одной части.6 × 10 9 . Магнитный момент антипротонов был измерен с погрешностью8 × 10 −3 ядерных магнетонов Бора , и оказывается равным протону и противоположным ему.
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
Что такое электроны
Электроны являются третьим типом субатомных частиц, и они находятся на орбите вокруг ядра атома в дискретных оболочках с дискретными уровнями энергии. Электроны отрицательно заряженныйи каждый электрон несет заряд, равный 1e. Вес электронов настолько мал, что считается незначительным по сравнению с массами протонов и нейтронов.
Так же, как число протонов, число электронов в атоме несет идентичность каждого элемента. То, как электроны распределяются в оболочках внутри каждого элемента, выражается их электронной конфигурацией. Количество электронов аналогично количеству протонов, найденных в элементе. Электроны обозначаются как ‘е. Электроны — единственная субатомная частица, которая участвует в химических реакциях. Они также принимают участие в определенных ядерных реакциях.
Что такое протон?
Протон — это субатомная частица в ядре атомов, имеющая положительный заряд. Обычно мы обозначаем его p. Когда ученые открыли электрон, они понятия не имели о частице под названием протон. Гольдштейн открыл положительно заряженную частицу, образовавшуюся из газов. Они были известны как анодные лучи. В отличие от электронов, они имели разное отношение заряда к массе в зависимости от используемого газа. После различных экспериментов многих ученых, наконец, Резерфорд открыл протон в 1917 году.
Число протонов в атоме химического элемента дает его атомный номер. Это потому, что атомный номер равен количеству протонов, которые элемент имеет в своем ядре. Например, атомный номер натрия 11; таким образом, у натрия в ядре одиннадцать электронов.
Кроме того, протон имеет заряд +1, а его масса составляет 1,6726 × 10−27 кг. Кроме того, он содержит три кварка, два верхних кварка и один нижний кварк. Это стабильная частица, потому что время ее распада очень велико. Самый простой элемент водород имеет только один протон. Когда атом водорода выпускает свой электрон, он образует ион H +, у которого есть протон. Поэтому в химии термин «протон» относится к иону H +. H + играет важную роль в кислотно-основных реакциях и является чрезвычайно реактивным веществом. Во всех остальных элементах, кроме водорода, больше одного протона. Обычно в нейтральных атомах количество отрицательно заряженных электронов и количество положительно заряженных протонов одинаковы.
Определение протона
Протон — еще одна крупная частица атома с зарядом положительной полярности. Это важный компонент атома, который образует ядро атома с нейтроном. Поскольку ядро атома находится в центре, таким образом, протон, несущий положительный заряд, присутствует в центре атомной
структуры.
Обозначается символом p и имеет положительный заряд, равный по модулю заряду электрона: р = +1,602 · 10-19 Кл.
Примечательно то, что количество протонов, присутствующих в атоме, обозначает его атомный номер. Протоны и нейтроны, содержащиеся в ядре атома вместе, называют нуклонами. Поскольку электроны и протоны имеют одинаковые по значению заряды, но противоположной полярности, то между ними, внутри атома, существует сила притяжения.
По этой причине электроны ограничены и движутся по орбитальному пути. У атома одинаковое количество электронов и протонов, поэтому положительный и отрицательный заряды аннулируются, что делает атом электрически нейтральным.
Электронные формулы ионов
Атомы могут отдавать и принимать электроны. Отдавая или принимая электроны, они превращаются в ионы.
Ионы — это заряженные частицы. Избыточный заряд обозначается индексом в правом верхнем углу.
Если атом отдаёт электроны, то общий заряд образовавшейся частицы будет положительный (вспомним, что число протонов в атоме равно числу электронов, а при отдаче электронов число протонов будет больше числа электронов). Положительно заряженные ионы — это катионы. Например: катион натрия образуется так:
+11Na 1s22s22p63s1 -1е =+11Na+ 1s22s22p63s
Если атом принимает электроны, то приобретает отрицательный заряд. Отрицательно заряженные частицы — это анионы. Например, анион хлора образуется так:
+17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно получить добавив или отняв электроны у атома
Обратите внимание, при образовании катионов электроны уходят с внешнего энергетического уровня. При образовании анионов электроны приходят на внешний энергетический уровень
Попробуйте составить самостоятельно электронный формулы ионов. Не забывайте проверять себя по ключам!
18. Ион Са2+
19. Ион S2-
20. Ион Ni2+
В некоторых случаях совершенно разные атомы образуют ионы с одинаковой электронной конфигурацией. Частицы с одинаковой электронной конфигурацией и одинаковым числом электронов называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия: Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора: F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные. Также они изоэлектронны атому неона.
Ответы на вопросы:
1. У изотопов одного химического элемента массовое число всегда разное, т.к. массовое число складывается из числа протонов и нейтронов. А у изотопов различается число нейтронов.
2. У изотопов одного элемента число протонов всегда одинаковое, т.к. число протонов характеризует химический элемент.
3. Массовое число изотопа брома-81 равно 81. Атомный номер = заряд ядра брома = число протонов в ядре = 35. Вычитаем из массового числа число протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный номер, заряд ядра и число протонов в ядре равно 17. Получаем число нейтронов = 37-17 =20.
5. Электронная формула азота:
+7N 1s22s22p3 1s 2s 2p
6. Электронная формула кислорода:
+8О 1s22s22p4 1s 2s 2p
7. Электронная формула фтора:
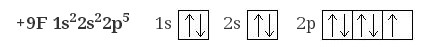
8. Электронная формула магния:
+12Mg 1s22s22p63s2 1s 2s 2p 3s
9. Электронная формула алюминия:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
10. Электронная формула кремния:
+14Si 1s22s22p63s23p2 1s 2s 2p 3s 3p
11. Электронная формула фосфора:
+15P 1s22s22p63s23p3 1s 2s 2p 3s 3p
12. Электронная формула серы:
+16S 1s22s22p63s23p4 1s 2s 2p 3s 3p
13. Электронная формула хлора:

14. Электронная формула аргона:
+18Ar 1s22s22p63s23p6 1s 2s 2p 3s 3p
15. Электронная формула углерода в возбуждённом состоянии:
+6C* 1s22s12p3 1s 2s 2p
16. Электронная формула бериллия в возбуждённом состоянии:
+4Be 1s22s12p1 1s 2s 2p
17. Электронная формула кислорода в возбуждённом энергетическом состоянии соответствует формуле кислорода в основном энергетическом состоянии, т.к. нет условий для перехода электрона — отсутствуют вакантные энергетические орбитали.
18. Электронная формула иона кальция Са2+: +20Ca2+ 1s22s22p63s23p6
19. Электронная формула аниона серы S2-: +16S2- 1s22s22p63s23p6
20. Электронная формула катиона никеля Ni2+: +28Ni2+ 1s22s22p63s23p63d84s
Обратите внимание! Атомы отдают электроны всегда сначала с внешнего энергетического уровня. Поэтому никель отдаёт электроны сначала с внешнего 4s-подуровня
Атом
Атом – мелкая частица, которая не разлагается в реакции на другие компоненты.
Есть что-то меньше вещества – это атомы.
Атомы можно различать по нескольким параметрам (приведем самые распространенные):
- Масса;
- Размер;
- Физические хар-ки;
- Химические хар-ки;
- Энергия;
- Вес атома.
Любой атом отличается от частицы другого элемента. Если сравнить атом водорода (Н) с атомом кислорода (О), то, очевидно, что у них будет несоответствие по многим характеристикам.
Размер атома
Если сравнить размеры атома и составляющих его частиц, то первый преобладает по своим масштабам. Ядро атома – ничто, по сравнению с ним самим. Взяв один кубический метр платины (Pt) и сплюснув его до такого состояния, где атомные расстояния просто бы исчезли, то он его кубический метр превратился бы в кубический миллиметр.
Из определения атома следует, что это маленькая частица. По форме они напоминают шар, а размер их поперечников составляет стомиллионную долю сантиметра. Чтобы это было нагляднее, рассмотрим поперечник атома водорода (Н), считающийся самым маленьким. Его размер составляет 10-8 доле сантиметра. Большим атомом является уран (U), чья величина составляет 3 х10-8 долей сантиметра.
Масштаб и вес атомов небольшие.
Вес атома
Чтобы посчитать вес какого-либо элемента, принято использовать 0,0625 долю кислорода (О), которая показывает насколько значение этого элемента больше. Если обратиться к таблице Менделеева, то можно увидеть под номерами всех элементов цифру, обозначающую атомный вес. Например, у водорода (Н) он составляет 1,008 (значение округляется, поэтому 1),а у радия – 226,025 (или же 226).Тут можно проследить разницу веса.
На заметку: при работе с периодической таблицей учтите, что если у вещества номер выше, тем вес атома будет больше.
Чаще всего у многих их вес будет дробный. Это объясняется тем, что они вмещают определенное количество частиц со своим весом, но признаки у всех абсолютно идентичны. Но такое не только у атомов. То же самое есть и самих элементов. Их называют изотопами.
Изотопы – химические элементы, занимающие один порядковый номер, но разную массу ядер.
Изотопы есть практически у каждого элемента (у кальция (Са) их целых четыре), при этом, чаще всего, их выводят искусственным путем.
История
Концепция водородоподобной частицы как составной части других атомов развивалась в течение длительного периода. Еще в 1815 году Уильям Праут предположил, что все атомы состоят из атомов водорода (которые он называл «протилами»), основываясь на упрощенной интерпретации ранних значений атомных весов (см . Гипотезу Праута ), которая была опровергнута, когда были получены более точные значения. измеряется.
Эрнест Резерфорд на первой Сольвеевской конференции , 1911 г.
Протон обнаружен в камере Вильсона изопропанола
В 1886 году Ойген Гольдштейн открыл канальные лучи (также известные как анодные лучи) и показал, что это положительно заряженные частицы (ионы), образованные из газов. Однако, поскольку частицы из разных газов имели разные значения отношения заряда к массе (э / м), их нельзя было идентифицировать с одной частицей, в отличие от отрицательных электронов, обнаруженных Дж . Дж. Томсоном . Вильгельм Вин в 1898 году определил ион водорода как частицу с самым высоким отношением заряда к массе в ионизированных газах.
После открытия атомного ядра Эрнестом Резерфордом в 1911 году Антониус ван ден Брук предположил, что место каждого элемента в периодической таблице (его атомный номер) равно его ядерному заряду. Это было подтверждено экспериментально Генри Мозли в 1913 году с использованием рентгеновских спектров .
В 1917 году (в экспериментах, опубликованных в 1919 и 1925 годах) Резерфорд доказал, что ядро водорода присутствует в других ядрах, результат обычно описывается как открытие протонов. Эти эксперименты начались после того, как Резерфорд заметил, что когда альфа-частицы выбрасываются в воздух (в основном азот), его сцинтилляционные детекторы показывают характерные черты типичных ядер водорода как продукта. После экспериментов Резерфорд проследил реакцию на азот в воздухе и обнаружил, что когда альфа-частицы вводились в чистый газообразный азот, эффект был сильнее. В 1919 году Резерфорд предположил, что альфа-частица просто выбила протон из азота, превратив его в углерод. После наблюдения изображений камеры Вильсона Блэкетта в 1925 году Резерфорд понял, что альфа-частица поглощается. После захвата альфа-частицы ядро водорода выбрасывается, так что в результате получается тяжелый кислород, а не углерод, т.е. Z не уменьшается, а увеличивается (см. Начальную предложенную реакцию ниже). Это было впервые сообщили ядерная реакция , 14 N + α → 17 O + р. Резерфорд сначала подумал о нашем современном «p» в этом уравнении как об ионе водорода H +.
В зависимости от точки зрения, 1919 год (когда экспериментально считалось, что он получен из другого источника, чем водород) или 1920 год (когда он был признан и предложен как элементарная частица) можно рассматривать как момент, когда протон был «открыт».
Резерфорд знал, что водород является самым простым и легким элементом, и на него повлияла гипотеза Праута о том, что водород является строительным блоком всех элементов. Открытие того, что ядро водорода присутствует в других ядрах как элементарная частица, привело Резерфорда к тому, чтобы дать ядру водорода H + особое имя как частица, поскольку он подозревал, что водород, самый легкий элемент, содержит только одну из этих частиц. Он назвал этот новый фундаментальный строительный блок ядра протоном в честь среднего единственного числа греческого слова, означающего «первый», πρῶτον. Однако Резерфорд также имел в виду слово « протил», использованное Праутом. Резерфорд выступил на заседании Британской ассоциации содействия развитию науки на ее заседании в Кардиффе, начавшемся 24 августа 1920 года. Резерфорд первым предположил (ошибочно, см. Выше), что эта реакция азота была 14 N + α → 14 C + α + H +. На встрече Оливер Лодж попросил его дать новое название положительному ядру водорода, чтобы его не путали с нейтральным атомом водорода. Первоначально он предлагал и протон, и прутон (после Праута). Позже Резерфорд сообщил, что собрание приняло его предложение назвать ядро водорода «протоном», следуя слову Праута «протил». Первое употребление слова «протон» в научной литературе появилось в 1920 году.
Стабильность
Нерешенная проблема в физике :
Принципиально ли протоны стабильны? Или они распадаются с конечным временем жизни, как предсказывают некоторые расширения стандартной модели?
(больше нерешенных задач по физике)
Свободный протон (протон, не связанный с нуклонами или электронами) — это стабильная частица, которая, как не наблюдалось, спонтанно распадается на другие частицы. Свободные протоны встречаются естественным образом в ряде ситуаций, в которых энергии или температуры достаточно высоки, чтобы отделить их от электронов, к которым они имеют некоторое сродство. Свободные протоны существуют в плазме, в которой температуры слишком высоки, чтобы позволить им соединяться с электронами . Свободные протоны высокой энергии и скорости составляют 90% космических лучей , которые распространяются в вакууме на межзвездные расстояния. Свободные протоны испускаются непосредственно из атомных ядер в некоторых редких типах радиоактивного распада . Протоны также возникают (наряду с электронами и антинейтрино ) в результате радиоактивного распада свободных нейтронов, которые нестабильны.
Спонтанный распад свободных протонов никогда не наблюдался, поэтому протоны считаются стабильными частицами согласно Стандартной модели. Однако некоторые теории великого объединения (GUT) физики элементарных частиц предсказывают, что распад протона должен происходить с временем жизни от 10 31 до 10 36 лет, а экспериментальные исследования установили нижние границы среднего времени жизни протона для различных предполагаемых продуктов распада.
Эксперименты на Супер-Камиоканд детекторе в Японии дали более низкие пределы для протонов средней продолжительности жизни в6,6 × 10 33 лет для распада на антимюон и нейтральный пион , и8,2 × 10 33 года для распада на позитрон и нейтральный пион. В другом эксперименте в нейтринной обсерватории Садбери в Канаде проводился поиск гамма-лучей, возникающих из остаточных ядер, возникающих в результате распада протона из кислорода-16. Этот эксперимент был разработан для обнаружения распада любого продукта и установил нижний предел времени жизни протона, равный2,1 × 10 29 лет .
Однако известно, что протоны превращаются в нейтроны в процессе захвата электронов (также называемого обратным бета-распадом ). Для свободных протонов этот процесс не происходит спонтанно, а только при подаче энергии. Уравнение:
- п+ + е- → п + νе
Процесс обратимый; нейтроны могут превращаться обратно в протоны посредством бета-распада , распространенной формы радиоактивного распада . Фактически, свободный нейтрон распадается таким образом со средним временем жизни около 15 минут.
Как найти нейтроны — ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента — атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
Базовая модель атома и атомная теория
Все вещества состоят из частиц, называемых атомами. Атомы связываются друг с другом, образуя элементы, и содержат только один вид атома.
Атомы различных элементов образуют соединения, молекулы и объекты.
Атом — это строительный блок материи, который нельзя разбить на части с помощью каких-либо химических средств.
Ядерные реакции могут изменить атомы.
Три части атома — это протоны (положительно заряженные), нейтроны (нейтральный заряд) и электроны (отрицательно заряженные).
Протоны и нейтроны образуют атомное ядро.
Электроны притягиваются к протонам в ядре, но движутся так быстро, что падают к нему (орбите), а не прилипают к протонам.
Идентичность атома определяется его числом протонов. Это также называется его атомным номером.
Части Атома
Атомы состоят из трех частей:
Протоны: протоны являются основой атомов. В то время как атом может получать или терять нейтроны и электроны, его идентичность связана с числом протонов. Символом числа протонов является заглавная буква Z.
Нейтроны: число нейтронов в атоме обозначается буквой N. Атомная масса атома является суммой его протонов и нейтронов или Z + N. Сильная ядерная сила связывает протоны и нейтроны вместе, образуя ядро атом.
Электроны: электроны намного меньше протонов или нейтронов и вращаются вокруг них.
Основные характеристики атомов:
Атомы не могут быть разделены с помощью химических веществ. Они состоят из частей, которые включают протоны, нейтроны и электроны, но атом является основным химическим строительным материалом материи. Ядерные реакции, такие как радиоактивный распад и деление, могут разрушать атомы.
Каждый электрон имеет отрицательный электрический заряд.
Каждый протон имеет положительный электрический заряд. Заряд протона и электрона равен по величине, но противоположен по знаку. Электроны и протоны электрически притягиваются друг к другу. Как заряды (протоны и протоны, электроны и электроны) отталкиваются друг от друга.
Каждый нейтрон электрически нейтрален; иными словами, нейтроны не имеют заряда и не притягиваются электрически ни к электронам, ни к протонам.
Протоны и нейтроны имеют примерно одинаковые размеры и намного больше электронов. Масса протона по существу такая же, как у нейтрона.
Масса протона в 1840 (!) раз больше массы электрона.
Ядро атома содержит протоны и нейтроны. Ядро несет положительный электрический заряд.
Электроны движутся вне ядра; они организованы в оболочки, которые являются областью наиболее вероятного их местонахождения.
Простые модели показывают, что электроны вращаются вокруг ядра по почти круговой орбите, подобно планетам, вращающимся вокруг звезды, но реальное поведение намного сложнее.
Некоторые электронные оболочки напоминают сферы, но другие больше похожи на тупые колокольчики или другие формы.
Технически, электрон может быть найден в любом месте в пределах атома, но проводит большую часть своего времени в области, описываемой орбиталью.
Электроны также могут перемещаться между орбиталями.
Атомы очень маленькие. Средний размер атома составляет около 100 пикометров или одну десятитысячную часть метра.
Почти вся масса атома находится в его ядре; почти весь объем атома занят электронами.
Количество протонов (также известно как его атомный номер) определяет элемент.
Изменение количества нейтронов приводит к образованию изотопов. Изменение числа электронов приводит к образованию ионов. Изотопы и ионы атома с постоянным числом протонов — это вариации одного элемента.
Частицы внутри атома связаны друг с другом мощными силами.
В общем, электроны легче добавлять или удалять из атома, чем протон или нейтрон.
Химические реакции в основном включают атомы или группы атомов и взаимодействия между их электронами.
Строение электронной оболочки
Согласно квантовой модели строение атома Нильса Бора, электроны в атоме могут двигаться только по определенным (стационарным) орбитам, удаленным от ядра на определенное расстояние и характеризующиеся определенной энергией. Другое название стационарны орбит — электронные слои или энергетические уровни.
Электронные уровни можно обозначать цифрами — 1, 2, 3, …, n. Номер слоя увеличивается мере удаления его от ядра. Номер уровня соответствует главному квантовому числу n.
В одном слое электроны могут двигаться по разным траекториям. Траекторию орбиты характеризует электронный подуровень. Тип подуровня характеризует орбитальное квантовое число l = 0,1, 2, 3 …, либо соответствующие буквы — s, p, d, g и др.
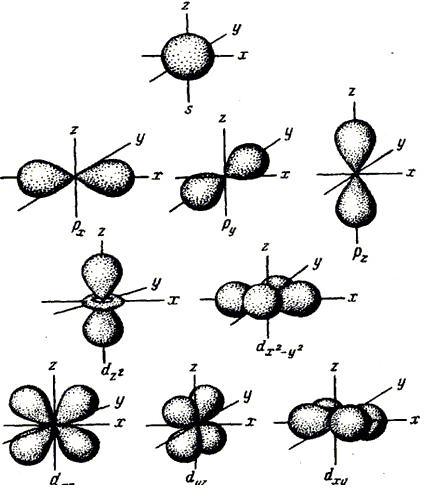
В рамках одного подуровня (электронных орбиталей одного типа) возможны варианты расположения орбиталей в пространстве. Чем сложнее геометрия орбиталей данного подуровня, тем больше вариантов их расположения в пространстве. Общее число орбиталей подуровня данного типа l можно определить по формуле: 2l+1. На каждой орбитали может находиться не более двух электронов.
| Тип орбитали | s | p | d | f | g |
| Значение орбитального квантового числа l | 1 | 2 | 3 | 4 | |
| Число атомных орбиталей данного типа 2l+1 | 1 | 3 | 5 | 7 | 9 |
| Максимальное количество электронов на орбиталях данного типа | 2 | 6 | 10 | 14 | 18 |
Получаем сводную таблицу:
|
Номер уровня, n |
Подуровень |
Число
АО |
Максимальное количество электронов |
| 1 | 1s | 1 | 2 |
| 2 | 2s | 1 | 2 |
| 2p | 3 | 6 | |
|
3 |
3s | 1 | 2 |
| 3p | 3 | 6 | |
| 3d | 5 | 10 | |
|
4 |
4s | 1 | 2 |
| 4p | 3 | 6 | |
| 4d | 5 | 10 | |
| 4f | 7 |
14 |
Заполнение электронами энергетических орбиталей происходит согласно некоторым основным правилам. Давайте остановимся на них подробно.
Принцип Паули (запрет Паули): на одной атомной орбитали могут находиться не более двух электронов с противоположными спинами (спин — это квантовомеханическая характеристика движения электрона).
Правило Хунда. На атомных орбиталях с одинаковой энергией электроны располагаются по одному с параллельными спинами. Т.е. орбитали одного подуровня заполняются так: сначала на каждую орбиталь распределяется по одному электрону. Только когда во всех орбиталях данного подуровня распределено по одному электрону, занимаем орбитали вторыми электронами, с противоположными спинами.
Таким образом, сумма спиновых квантовых чисел таких электронов на одном энергетическом подуровне (оболочке) будет максимальной.
Например, заполнение 2р-орбитали тремя электронами будет происходить так: , а не так:
Принцип минимума энергии. Электроны заполняют сначала орбитали с наименьшей энергией. Энергия атомной орбитали эквивалентна сумме главного и орбитального квантовых чисел: n + l. Если сумма одинаковая, то заполняется первой та орбиталь, у которой меньше главное квантовое число n.
| АО | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| n | 1 | 2 | 2 | 3 | 3 | 3 | 4 | 4 | 4 | 4 | 5 | 5 | 5 | 5 | 5 |
| l | 1 | 1 | 2 | 1 | 2 | 3 | 1 | 2 | 3 | 4 | |||||
| n + l | 1 | 2 | 3 | 3 | 4 | 5 | 4 | 5 | 6 | 7 | 5 | 6 | 7 | 8 | 9 |
Таким образом, энергетический ряд орбиталей выглядит так:
1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
Электронную структуру атома можно представлять в разных формах — энергетическая диаграмма, электронная формула и др. Разберем основные.
Энергетическая диаграмма атома — это схематическое изображение орбиталей с учетом их энергии. Диаграмма показывает расположение электронов на энергетических уровнях и подуровнях. Заполнение орбиталей происходит согласно квантовым принципам.
Например, энергетическая диаграмма для атома углерода:
Электронная формула — это запись распределения электронов по орбиталям атома или иона. Сначала указывается номер уровня, затем тип орбитали. Верхний индекс справа от буквы показывает число электронов на орбитали. Орбитали указываются в порядке заполнения. Запись 1s2 означает, что на 1 уровне s-подуровне расположено 2 электрона.
Например, электронная формула углерода выглядит так: 1s22s22p2.
Для краткости записи, вместо энергетических орбиталей, полностью заполненных электронами, иногда используют символ ближайшего благородного газа (элемента VIIIА группы), имеющего соответствующую электронную конфигурацию.
Например, электронную формулу азота можно записать так: 1s22s22p3 или так: 2s22p3.
1s2 =
1s22s22p6 =
1s22s22p63s23p6 = и так далее.
Атомы и изотопы
Атомы того же элемента содержат одно и то же число протонов. У всех атомов меди 29 протонов. У всех атомов гелия есть 2 протона. Изотопы возникают, когда атомы одного и того же элемента имеют разные массы. Поскольку число протонов элемента не меняется, разница в массе возникает из-за разного числа нейтронов. Медь, например, имеет два изотопа: медь-63 и медь-65. Медь-63 содержит из 29 протонов и ей свойственно массовое число 63. Медь-65 вмещает 29 протонов, а ее массовое число составляет 65. Гелий содержит 2 протона и почти всегда имеет массовое число 4. Очень редко гелий образует изотоп гелий-3, который по-прежнему имеет 2 протона, но имеет массовое число 3.
Один из методов написания формулы для изотопа показывает имя элемента, за которым следует массовое число, например, гелий-4 или He-4. Другая сокращенная идентификация изотопов демонстрирует массовое число в верхнем индексе и атомный номер в нижнем, оба показаны перед атомным символом.