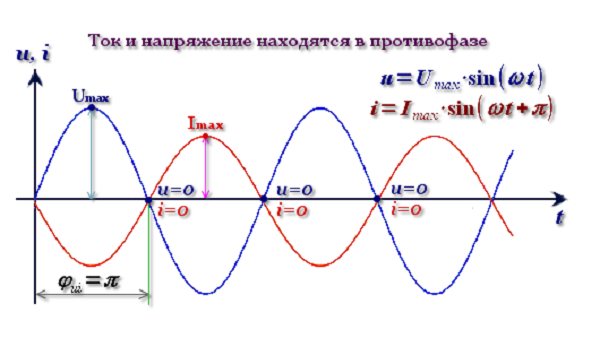
Содержание
Самые популярные аноды
В металлургии используется анод для гальваники для того, чтобы наносить на поверхность изделий слой металла электрохимическим способом или для электрорафинирования. При этом процессе металл с примесями полностью растворяется на аноде, а потом осаждается в чистом виде на катоде.
В основном распространены аноды из цинка, которые могут быть литыми, сферическими, катаными. Причем последние используются чаще всего. Кроме того, берут аноды из никеля, меди, олова, бронзы, кадмия, сплава сурьмы и свинца, серебра, платины и золота. А вот из кадмия аноды почти не используют, что обуславливается их экологической вредностью. Анод из драгоценных металлов используют для того, чтобы повысить коррозионную стойкость, улучшить эстетические свойства предметов, а также для других целей. Кроме того, они пригодятся и для того, чтобы повысить электропроводность изделий.
В вакуумных электронных приборах анод – это специальный электрод, который способен притягивать к себе любые летящие электроны, которые испущены катодом. В рентгеновских трубках и электронных лампах он имеет такую конструкцию, когда полностью поглощает все электроны. В электронно-лучевых трубках аноды являются элементами электронной пушки, которые поглощают только часть летящих электронов, формируя при этом электронный луч после себя. В полупроводниковых приборах электроды, которые подключаются к положительному источнику тока, когда прибор открыт, то есть он имеет небольшое сопротивление, называют анодом, а тот, что подключен к отрицательному полюсу, соответственно, – катодом.
Знак анода и катода
В специальной литературе часто можно встретить самое разное обозначение знака анода: «+» или «-». Это определяется особенностями рассматриваемых процессов. К примеру, в электрохимии считают, что катод – это электрод, на котором протекает процесс восстановления, а анод – это электрод, на котором протекает процесс окисления. При активной работе электролизера внешний источник тока обеспечивает на одном электроде избыток электронов и здесь происходит восстановление металла. Этот электрод является катодом. А на другом электроде, в свою очередь, обеспечивается недостаток электронов и происходит окисление металла, и его называют анодом.
При работе гальванического элемента, на одном из электродов избыток электронов обеспечивается уже не внешним источником тока, а именно реакцией окисления металла, то есть здесь отрицательным будет уже анод. Электроны, которые проходят через внешнюю цепь, будут расходоваться на протекание реакции восстановления, то есть катодом можно назвать положительный электрод.
Исходя из такого толкования, для аккумулятора аноды и катоды меняются местами в зависимости от того, как направлен ток внутри аккумулятора. В электротехнике анодом называют положительный электрод. Так электрический ток течет от анода к катоду, а электроны – наоборот.
Только в одном направлении. Когда-то давно применялись ламповые диоды . Но сейчас используются в основном полупроводниковые диоды. В отличие от ламповых они значительно меньше по размеру, не требуют цепей накала и их очень просто соединять различным образом.
Условное обозначение
диода на схеме
На рисунке показано условное обозначение диода на схеме. Буквами А и К соответственно обозначены анод диода и катод диода. Анод диода – это вывод, который подключается к положительному выводу , непосредственно или через элементы схемы. Катод диода – это вывод из которого выходит ток положительного потенциала и далее через элементы схемы попадает на отрицательный электрод источника тока. Т.е. ток через диод идёт от анода к катоду. А в обратном направлении диод ток не пропускает. Если каким-то из своих выводов диод подключается к , то на другом его выводе получается постоянное напряжение с полярностью, зависящей от того, как диод подключен. Если он подключен анодом к переменному напряжению, то с катода мы получим положительное напряжение. Если он подключен катодом, то с анода будет получено соответственно отрицательное напряжение.
История
Слово «электролиз» было введено Майклом Фарадеем в 19 веке по предложению преподобного Уильяма Уэвелла с использованием греческих слов ἤλεκτρον «янтарь», который с 17 века ассоциировался с электрическими явлениями , и λύσις означает «растворение». Тем не менее, электролиз как инструмент для изучения химических реакций и получения чистых элементов предшествует введению термина и формальному описанию Фарадеем.
В начале девятнадцатого века Уильям Николсон и Энтони Карлайл пытались продолжить эксперименты Вольты . Они прикрепили два провода по обе стороны от батареи Вольта, а другие концы поместили в трубку, наполненную водой. Они заметили, когда провода были соединены вместе, что каждая из них образовывала пузыри. Один тип — водород, другой — кислород.
В 1785 году голландский ученый по имени Мартинус Ван Марум создал электростатический генератор, который он использовал для восстановления олова, цинка и сурьмы из их солей с помощью процесса, позже известного как электролиз. Хотя он неосознанно производил электролиз, только в 1800 году Уильям Николсон и Энтони Карлайл обнаружили, как работает электролиз.
В 1791 году Луиджи Гальвани экспериментировал с лягушачьими лапками. Он утверждал, что размещение мышц животного между двумя разными металлическими листами привело к появлению электричества. В ответ на эти утверждения Алессандро Вольта провел собственные тесты. Это могло бы пролить свет на идеи Хэмфри Дэви по электролизу. Во время предварительных экспериментов Хамфри Дэви предположил, что когда два элемента соединяются вместе, образуя соединение, высвобождается электрическая энергия. Хамфри Дэви продолжил создавать таблицы разложения на основе своих предварительных экспериментов по электролизу. Таблицы разложения дадут представление об энергиях, необходимых для разложения определенных соединений.
В 1817 году Йохан Август Арфведсон определил, что в некоторых из его образцов есть еще один элемент, литий; однако он не мог изолировать компонент. Только в 1821 году Уильям Томас Бранде использовал электролиз, чтобы выделить его. Два года спустя он оптимизировал процесс, используя хлорид лития и хлорид калия с электролизом для получения лития и гидроксида лития.
В более поздние годы исследований Хэмфри Дэви его помощником стал Майкл Фарадей. Изучая процесс электролиза под руководством Хамфри Дэви, Майкл Фарадей открыл два закона электролиза .
Во времена Максвелла и Фарадея возникли опасения по поводу электроположительной и электроотрицательной активности.
В ноябре 1875 года Поль Эмиль Лекок де Буабодран открыл галлий, используя электролиз гидроксида галлия, с получением 3,4 мг галлия. В декабре он представил свое открытие галлия Академии наук в Париже.
26 июня 1886 года Фердинанд Фредерик Анри Муассан наконец почувствовал себя комфортно, проводя электролиз на безводном фтористом водороде для создания газообразного элемента с чистым фтором. Прежде чем использовать фтористый водород, Анри Муассан использовал фторидные соли при электролизе. Таким образом, 28 июня 1886 года он провел свой эксперимент перед Академией наук, чтобы продемонстрировать свое открытие нового элемента фтора. Ценой попыток найти элементарный фтор путем электролиза фторидных солей погибли многие химики, в том числе Полен Луайе и Жером Никлес.
В 1886 году Чарльз Мартин Холл из Америки и Поль Эру из Франции подали заявки на американские патенты, Эру — в мае, а Холл — в июле. Холл смог получить свой патент, доказав в письмах своему брату и семье свидетельства того, что его метод был открыт до того, как был подан французский патент. Это стало известно как процесс Холла-Эру, который принес пользу многим отраслям промышленности, потому что цена на алюминий упала с четырех долларов до тридцати центов за фунт.
График
- 1785 г. — электростатический генератор Мартинуса ван Марума был использован для восстановления олова , цинка и сурьмы из их солей с помощью электролиза.
- 1800 — Уильям Николсон и Энтони Карлайл (а также Иоганн Риттер ) разложили воду на водород и кислород .
- 1808 — Калий (1807), натрий (1807), барий , кальций и магний были открыты с помощью электролиза.
- 1821 — Литий был открыт английским химиком Уильямом Томасом Бранде , который получил его электролизом оксида лития.
- 1834 г. — Майкл Фарадей опубликовал свои два закона электролиза , дал им математическое объяснение и ввел такие термины, как электрод, электролит, анод, катод, анион и катион.
- 1875 — Поль Эмиль Лекок де Буабодран открыл галлий с помощью электролиза.
- 1886 — Анри Муассан открыл фтор с помощью электролиза.
- 1886 — Разработан процесс Холла-Эру для производства алюминия.
- 1890 — Разработан процесс Кастнера – Келлнера для производства гидроксида натрия .
Основные свойства катодов
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Будет интересно Что такое электролиз и где он применяется на практике
https://youtube.com/watch?v=-nbYBPM7rb0
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов.Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода. Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна.
Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки. При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается. Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
Как работает гальванизация.
током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl2O3). Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
https://youtube.com/watch?v=bpcnqZs7-Lo
https://youtube.com/watch?v=PckDwQmwplg
https://youtube.com/watch?v=bqpq_2PNbtw
Разбираемся с электрическим аккумулятором
Это по-настоящему классический пример химического источника электрического тока, что является возобновляемым. Аккумулятор пребывает в одном из двух режимов: заряд/разряд. В обоих этих случаях будет разное направление электрического тока
Но обратите внимание, что полярность электродов при этом меняться не будет. И они могут выступать в разных ролях:
- Во время зарядки положительный электрод принимает электрический ток и является анодом, а отрицательный его отпускает и именуется катодом.
- При отсутствии движения о них разговор вести нет смысла.
- Во время разряда положительный электрод отпускает электрический ток и является катодом, а отрицательный принимает и именуется анодом.
Направления исследований
Электролиз углекислого газа
Электрохимическое восстановление или электрокаталитическое преобразование CO 2 может давать химические вещества с добавленной стоимостью, такие как метан , этилен , этанол и т. Д. Электролиз диоксида углерода дает формиат или монооксид углерода, но иногда и более сложные органические соединения, такие как этилен . Эта технология изучается как углеродно-нейтральный путь к органическим соединениям.
Электролиз подкисленной воды
Электролиз воды производит водород и кислород в соотношении 2: 1 соответственно.
- 2 H 2 O (л) → 2 H 2 (г) + O 2 (г); E = +1,229 В
Энергетическая эффективность электролиза воды колеблется в широких пределах. Эффективность электролизера — это мера энтальпии, содержащейся в водороде (для сгорания с кислородом или какой-либо другой более поздней реакции), по сравнению с подводимой электрической энергией. Значения теплоты / энтальпии для водорода хорошо опубликованы в научных и технических текстах и составляют 144 МДж / кг
Обратите внимание, что топливные элементы (не электролизеры) не могут использовать это полное количество тепла / энтальпии, что привело к некоторой путанице при вычислении значений эффективности для обоих типов технологий. В реакции часть энергии теряется в виде тепла
В некоторых отчетах указывается эффективность от 50% до 70% для щелочных электролизеров; однако гораздо более высокая практическая эффективность доступна при использовании электролиза с полимерным электролитом с мембраной и каталитической технологии, например 95% эффективности.
Национальная лаборатория возобновляемой энергии по оценкам , что 1 кг водорода (примерно эквивалентно 3 кг, или 4 л, нефти с точки зрения энергии) может быть получен путем Ветряные электролиза между $ 5,55 в ближайшем будущем и $ 2,27 в долгосрочной перспективе.
Около 4% газообразного водорода, производимого во всем мире, вырабатывается путем электролиза и обычно используется на месте. Водород используется для производства аммиака для удобрений с помощью процесса Габера и преобразования тяжелых нефтяных источников в более легкие фракции посредством гидрокрекинга . В последнее время для улавливания водорода в водородных топливных элементах в водородных транспортных средствах используется электролиз на месте .
Электролиз воды с использованием углерода / углеводородов
В последнее время для снижения энергозатрат использование углерода ( уголь ), спиртов (углеводородный раствор) и органических растворов ( глицерин , муравьиная кислота, этиленгликоль и т. Д.) При совместном электролизе воды было предложено в качестве жизнеспособного варианта. . Процесс электролиза воды с использованием углерода / углеводородов (так называемый CAWE) для производства водорода будет выполнять эту операцию в одном электрохимическом реакторе. Этот энергетический баланс системы может потребоваться только около 40% потребляемой электроэнергии, при этом 60% приходится на химическую энергию углерода или углеводорода. В этом процессе в качестве топлива используются твердые частицы угля / углерода или порошок в качестве топлива, диспергированного в кислотном / щелочном электролите в виде суспензии, а углеродсодержащий источник участвует в процессе электролиза в соответствии со следующими теоретическими общими реакциями:
Углеродно-угольная суспензия (C + 2H 2 O) -> CO 2 + 2H 2 E ‘= 0,21 В (обратимое напряжение) / E’ = 0,46 В (термо-нейтральное напряжение)
или
Углеродно-угольная суспензия (C + H 2 O) -> CO + H 2 E ‘= 0,52 В (обратимое напряжение) / E’ = 0,91 В (термо-нейтральное напряжение)
Таким образом, этот подход CAWE заключается в том, что фактическое перенапряжение ячейки может быть значительно снижено до уровня ниже 1 В по сравнению с 1,5 В для обычного электролиза воды.
Электрокристаллизация
Специализированное применение электролиза включает рост проводящих кристаллов на одном из электродов из окисленных или восстановленных частиц, которые образуются на месте. Метод был использован для получения монокристаллов низкоразмерных электрических проводников, таких как соли с переносом заряда и соединения с линейной цепью.
Как определить, где анод, а где катод?
При определении катода и анода необходимо в первую очередь ориентироваться на направление тока, а не на полярность источника питания. Несмотря на то, что эти понятия тесно связаны с полярностью тока, они больше обусловлены направлениями векторов электричества.
Например, в аккумуляторах, при перезарядке, происходит изменение ролей катода и анода. Это связано с тем, что во время зарядки изменяется направление электрического тока. Электрод, выполнявший роль электрода при работе аккумулятора в режиме источника питания во время зарядки выполняет функции катода и наоборот – катод превращается в анод.
На рис. 1, изображено процесс электролиза, при котором происходит перемещение анионов (отрицательных ионов) и катионов (положительных ионов). Анионы устремляются к аноду, а положительные катионы – в сторону катода.
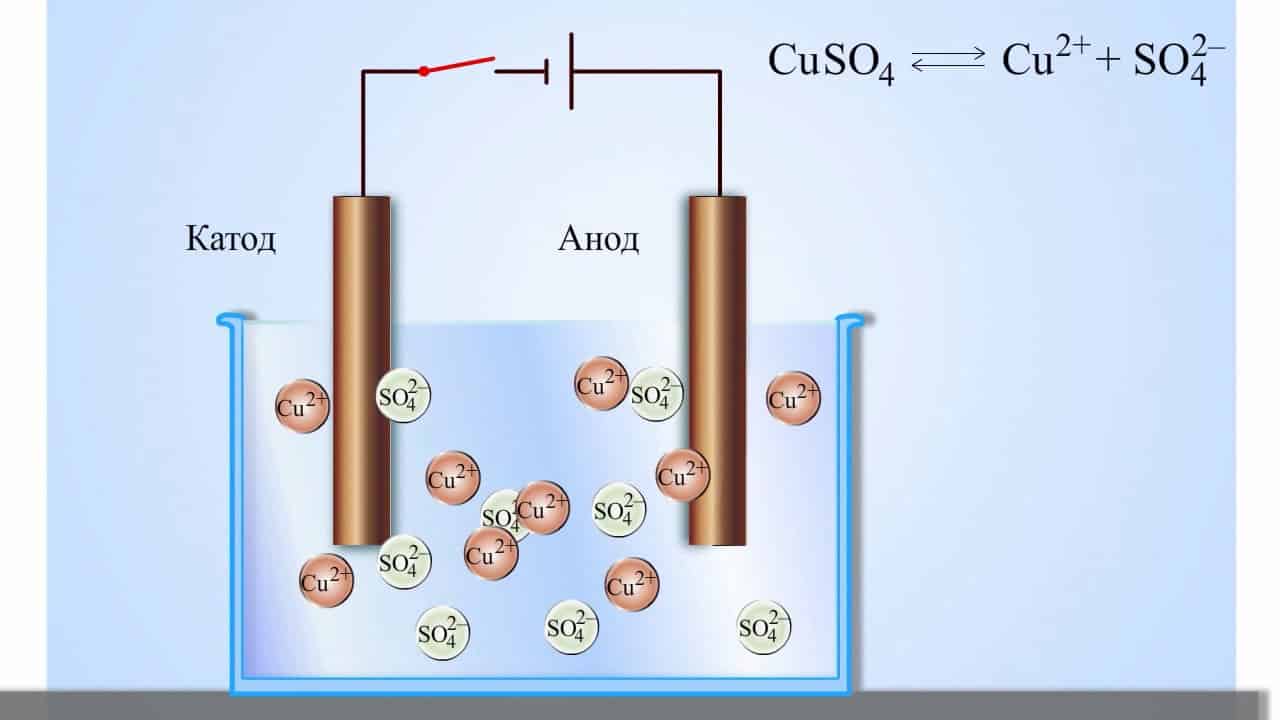
Рис. 1. Электролиз
При электролизе перемещаются носители зарядов разных знаков, однако, по определению, анодом является тот электрод, в который втекает ток. На рисунке анод подсоединён к положительному полюсу источника тока, а значит, ток условно втекает в этот электрод.
Обратите внимание на рисунок 2, где изображена схема гальванического элемента. Рис
2. Гальванический элемент
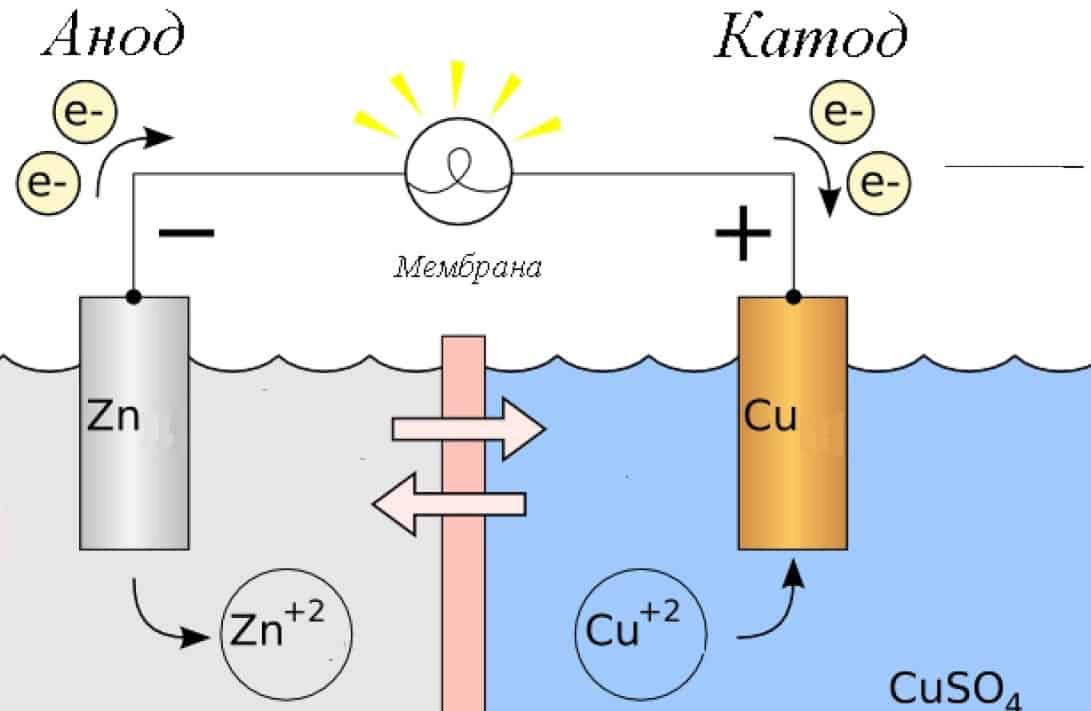
Рис. 2. Гальванический элемент
Плюсовой вывод источника тока является катодом, а не анодом, как можно было бы ожидать. При внимательном изучении принципа работы гальванического элемента можно понять, почему анод является отрицательным полюсом.
Обратите внимание на рисунок строения гальванического источника тока. Стрелки (вверху) указывают направление движения электронов, однако направлением тока условно принято считать перемещение от плюса к минусу
То есть, при замыкании цепи, ток входит именно в отрицательный полюс, который и является анодом, на котором происходит реакция окисления. Иначе говоря, ток от положительного электрода через нагрузку попадает на анод, являющийся отрицательным полюсом гальванического элемента. При вдумчивом подходе все стает на свои места.
При определении позиций анода и катода в радиоэлектронных элементах пользуются справочными материалами.
На назначение электродов указывает:
- форма корпуса (рис. 3);
- длина выводов (для светодиодов) (рис. 4);
- метки на корпусах приборов или знака анода;
- различная толщина выводов диода.

Рис. 3. Диод
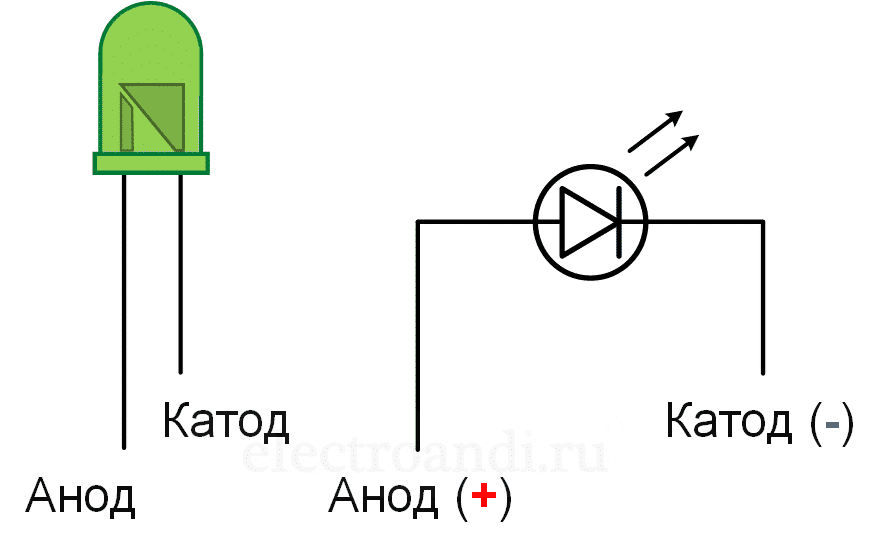
Рис. 4. Электроды светодиода Определение назначений выводов у полупроводниковых диодов можно определить с помощью измерительных приборов. Например, все типы диодов (кроме стабилитронов) проводят ток только в одном направлении. Если вы подключили тестер или омметр к диоду, и он показал незначительное сопротивление, то к положительному щупу прибора подключен анод, а к отрицательному – катод.
Если известен тип проводимости транзистора, то с помощью того же тестера можно определить выводы эмиттера и коллектора. Между ними сопротивление бесконечно велико (тока нет), а между базой и каждым из них проводимость будет (только в одну сторону, как у диода). Зная тип проводимости, по аналогии с диодом, можно определить: где анод, а где катод, а значит определить выводы коллектора или эмиттера (см. рис. 5).

Рис. 5. Транзистор на схемах и его электроды
Что касается вакуумных диодов, то их невозможно проверить путем измерения обычными приборами. Поэтому их выводы расположены таким образом, чтобы исключить ошибки при подключении. В электронных лампах выводы точно совпадают с расположением контактов гнезда, предназначенного для этого радиоэлемента.
Жертвенный анод
Расходуемые аноды, устанавливаемые «на лету» для защиты металлических конструкций от коррозии.
При катодной защите металлический анод, который более реагирует на коррозионную среду, чем металлическая система, которую необходимо защитить, электрически связан с защищаемой системой. В результате металлический анод частично корродирует или растворяется вместо металлической системы. Например, корпус корабля из железа или стали может быть защищен цинковым анодом , который растворяется в морской воде и предотвращает коррозию корпуса. Жертвенные аноды особенно необходимы для систем, в которых статический заряд создается под действием текущих жидкостей, таких как трубопроводы и плавсредства. Протекторные аноды также обычно используются в водонагревателях резервуарного типа.
В 1824 году, чтобы уменьшить воздействие этого разрушительного электролитического воздействия на корпуса кораблей, их крепления и подводное оборудование, ученый-инженер Хэмфри Дэви разработал первую и до сих пор наиболее широко используемую систему защиты от электролиза для судов . Дэви установил расходуемые аноды, сделанные из более электрически реактивного (менее благородного) металла, прикрепленные к корпусу судна и электрически связанные, чтобы сформировать цепь катодной защиты.
Менее очевидным примером этого типа защиты является процесс цинкования железа. Этот процесс покрывает железные конструкции (например, ограждения) покрытием из металлического цинка . Пока цинк остается неповрежденным, железо защищено от воздействия коррозии. Неизбежно происходит повреждение цинкового покрытия в результате растрескивания или физического повреждения. Когда это происходит, коррозионные элементы действуют как электролит, а комбинация цинка и железа — как электроды. Результирующий ток гарантирует, что цинковое покрытие будет потеряно, но основное железо не подвергнется коррозии. Такое покрытие может защитить железную конструкцию в течение нескольких десятилетий, но как только защитное покрытие израсходовано, железо быстро корродирует.
Если же, наоборот, олово используется для покрытия стали, то при нарушении покрытия оно фактически ускоряет окисление железа.
Определение анода и катода
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82. ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается. Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах – зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным, хотя полярность электродов не меняется.
В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке – наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны.
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, – записал в своих исследованиях М.Фарадей в январе 1834г., – я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем? А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их необходимо отличать от полюсов». В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя» при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Обозначение анода и катода
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток – анодом, а ту, которая направлена на запад – катодом». В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод – путь (солнца) вверх, катод – путь (солнца) вниз.
В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
Ошибкам в применениях терминов АНОД и КАТОД нет числа. В том числе и в зарубежных справочниках и энциклопедиях. Поэтому в электрохимии пользуются другими определениями, более понятными читателю. У них анод – это электрод, где протекают окислительные процессы, а катод – это электрод, где протекают восстановительные процессы. В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).
Как работает батарейка.